Influencia de la calidad del agua y el manejo en la condición sanitaria de la trucha arcoíris (Oncorhynchus mykiss) en piscigranjas de la región Amazonas
Influence of water quality and management on the health status of rainbow trout (Oncorhynchus mykiss) in trout farm of the Amazon region
Segundo Portocarrero1,a,*, Yesica Rojas1,b, Joseph Bardales1,c, William Bardales1,d, Ilse Cayo1,e
1 Universidad Nacional Toribio Rodríguez de Mendoza de Amazonas, Chachapoyas, Perú.
a Ing.,
![]() segundo.portocarrero@untrm.edu.pe,
segundo.portocarrero@untrm.edu.pe, ![]() https://orcid.org/0000-0003-2332-9792
https://orcid.org/0000-0003-2332-9792
b M.V., ![]() yesica.rojas@untrm.edu.pe,
yesica.rojas@untrm.edu.pe, ![]() https://orcid.org/0000-0002-9117-9266
https://orcid.org/0000-0002-9117-9266
c Ing., ![]() joseph.bardales@untrm.edu.pe,
joseph.bardales@untrm.edu.pe, ![]() https://orcid.org/0000-0002-3346-1183
https://orcid.org/0000-0002-3346-1183
d M.Sc., ![]() william.bardales@untrm.edu.pe,
william.bardales@untrm.edu.pe, ![]() https://orcid.org/0000-0001-9721-9057
https://orcid.org/0000-0001-9721-9057
e Ph.D., ![]() icayo.fizab@untrm.edu.pe,
icayo.fizab@untrm.edu.pe, ![]() https://orcid.org/0000-0001-6518-0979
https://orcid.org/0000-0001-6518-0979
* Autor de Correspondencia: Tel. +51 935430957
http://doi.org/10.25127/riagrop.20232.910
Resumen
Con el objetivo de evaluar la influencia de la calidad del agua y el manejo en la condición sanitaria de la trucha arcoíris (Oncorhynchus mykiss) en piscigranjas de la región Amazonas se realizó el análisis físico-químico y microbiológico del agua en 14 piscigranjas de la región Amazonas, una encuesta a los productores y se evaluaron 140 muestras de trucha en etapa comercial con el fin de identificar lesiones macroscópicas. Los datos fueron analizados usando el software Statistix versión 8.0 mediante el análisis de varianza, prueba t de Student, prueba de comparación de Tuckey y la correlación de rangos de Spearman. El análisis microbiológico muestra que 6 piscigranjas evaluadas se encuentran por encima de los límites máximos permitidos para coliformes fecales (200 NMP/ml) y los análisis de correlación evidencian asociación altamente significativa (p<0.01) entre parámetros físico-químicos del agua y el manejo con las lesiones encontradas en las truchas.
Palabras claves: Influencia; físico-químico; microbiológico; Oncorhynchus mykiss.
Abstract
To evaluate the influence of water quality and rainbow trout (Oncorhynchus mykiss) management on the sanitary condition of trout farms from the Amazonas region, water physical-chemical and microbiological analysis and surveys of each breeder were conducted in 14 trout farms. Also, 140 commercial stage-trout samples were taken to the laboratory to identify macroscopic lesions. The data were analyzed using Statistix software version 8.0 through analysis of variance, Student's t-test, Tuckey comparison test, and Spearman rank correlation. The microbiological analysis shows that six trout farms are above the maximum limits allowed for fecal coliforms (200 NMP / ml), and the correlation analyses show a highly significant association (p <0.01) between physical-chemical parameters of the water and the management since injuries were found in the trout.
Keywords: influence; physical-chemical; microbiological; Oncorhynchus mykiss.
1. INTRODUCCIÓN
En el Perú, el pescado azul de agua dulce que más se cultiva es la trucha arco iris (Oncorhynchus mykiss) y es considerada la más relevante, especialmente en las zonas altoandinas (Yunis et al., 2015). La trucha arcoíris es una especie íctica perteneciente a la familia Salmonidae (FAO, 2019), originaria de las costas del Pacífico de América del Norte, debido a su fácil adaptación al cautiverio ha sido ampliamente distribuida en los cuerpos de aguas frías de muchos países del mundo. En América del Sur, se encuentra distribuida en Argentina, Brasil, Bolivia Chile, Colombia, Ecuador, Perú y Venezuela (Hardy et al., 2000).
El éxito de la crianza acuícola está condicionado por diversos factores, entre las que destacan la calidad de agua y el manejo sanitario. La calidad del agua es determinante en la producción piscícola, cualquier cambio en los parámetros físico-químicos y microbiológicos puede provocar una baja en la producción e inclusive su pérdida total, además los productos acuícolas se pueden ver afectados por el deterioro de la calidad de éstos (Oliva, 2011), cada especie tiene un perfil idóneo de parámetros de calidad de agua, de manera que cuando los niveles estén fuera del rango tolerable sufrirán estrés, y probablemente serán incapaces de sobrevivir. Los parámetros medio ambientales pueden alterar la calidad del agua, dañando los tejidos y afectando el estado sanitario del pez; induciéndole a niveles altos de stress que a su vez conduce a una reducción en la resistencia a enfermedades (Llerena, 2007).
La experiencia en muchos lugares del mundo ha demostrado que la condición sanitaria de los peces juega un papel preponderante en el resultado técnico y/o económico de cualquier sistema acuícola (Smith et al, 2001). Por lo tanto, son muchos los factores a considerar en la producción de trucha arcoíris, teniendo en cuenta que el estatus microbiológico del agua empleada para la crianza de los peces dulceacuícolas, influyen directamente en los sistemas de producción, dado que favorece la formación de lesiones y/o erosiones epiteliales en truchas criadas en estanques piscícolas (García et al, 2003).
Las normas de salud pública respaldan el consumo de productos acuícolas, evitando la presencia de peligros biológicos y químicos; los mismos que pueden precaverse mediante los estudios preventivos de las condiciones de crianza, así como el establecimiento de buenas prácticas de producción y control (Pis et al, 2008).
Por lo tanto, el presente trabajo de investigación busca evaluar la influencia de la calidad del agua y el manejo sanitario de la trucha arcoíris (Oncorhynchus mykiss) en piscigranjas de la región Amazonas.
2. MATERIALES Y MÉTODOS
2.1. Lugar de estudio
De un total de 30 piscigranjas distribuidas en las provincias de la región Amazonas (Figura 1), se realizó el estudio en 14 piscigranjas dedicadas a la producción de trucha arco iris (Oncorhynchus mykiss), seleccionando a las que tuvieron como fuente de abastecimiento agua de primer uso para esta actividad y similares condiciones en las instalaciones.
El estudio se realizó en 14 piscigranjas distribuidas en 04 provincias de Amazonas (Tabla 1).
2.2. Determinación de parámetros físico - químicos
Los parámetros físico-químicos (temperatura, pH, oxígeno disuelto y sólidos totales en suspensión) fueron medidos in situ en cada piscigranja con un multiparámetro portátil (modelo HI 9829, HANNA, USA). Para el análisis microbiológico de coliformes fecales, se colectó 100 ml de agua en frascos de vidrio esterilizados, y transportados a 4°C hasta su procesamiento en el Laboratorio de Enfermedades Infecciosas y Parasitarias de Animales Domésticos de la Universidad Nacional Toribio Rodríguez de Mendoza, según la técnica del número más probable establecido por Standard Methods for the Examination of Water and Wastewater (APHA, 2017).
2.3. Identificación de lesiones en truchas arcoíris
Se recolectó 10 muestras de truchas por piscigranja con peso promedio de 200 gramos y 22 cm de longitud, en bolsas ziploc y fueron identificadas según su origen. Para garantizar la conservación de la muestra se acondicionaron contenedores con geles refrigerantes y fueron trasladados al Laboratorio de Enfermedades Infecciosas y Parasitarias de Animales Domésticos de la Universidad Nacional Toribio Rodríguez de Mendoza, los que fueron evaluados según el formato anamnésico básico establecido en el Manual de Métodos de Diagnóstico en Ictiopatología con Especial Referencia a los Salmónidos, establecido por la Organización de las Naciones Unidas para la Agricultura y la Alimentación. (FAO, 1987).
2.4. Buenas prácticas de manejo sanitario
Las buenas prácticas de manejo sanitario fueron determinadas a partir de las encuestas tomadas a los 14 productores que participaron en esta investigación. Las encuestas fueron validadas por juicio de expertos (FAO, 2014).
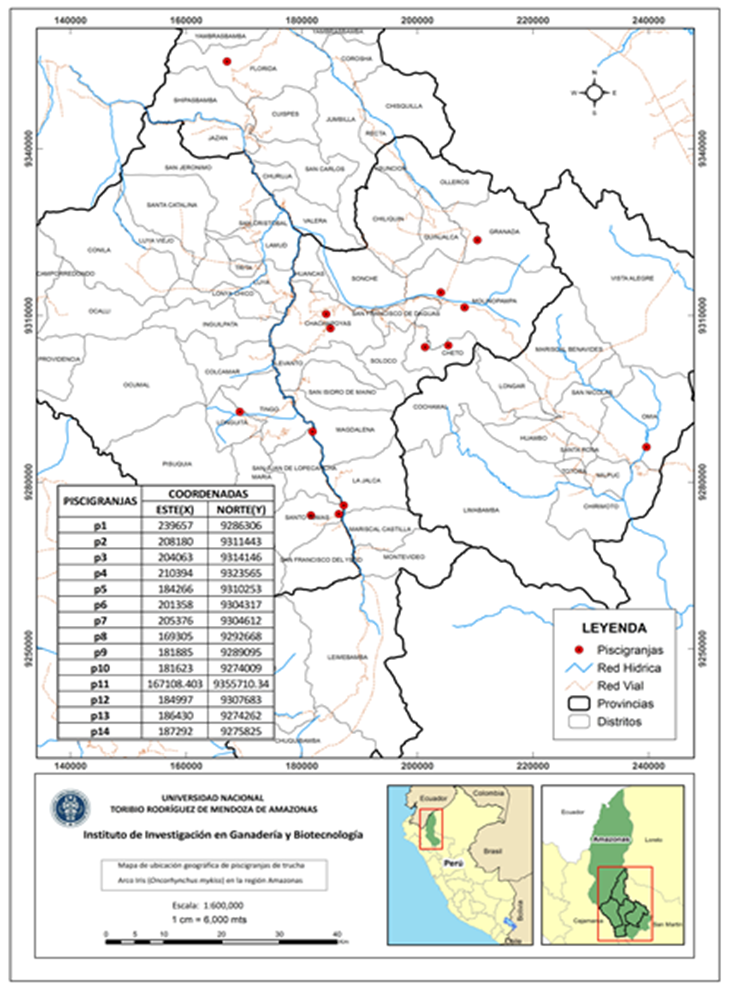
Figura 1. Mapa de ubicación geográfica de las piscigranjas.
Tabla 1. Puntos georreferenciales de las piscigranjas
|
Piscigranja (P) |
Coordenadas |
Altitud (msnm) |
Provincia |
|
P1 |
2396 57, 9286306 |
1508 |
Rodríguez de Mendoza |
|
P2 |
208180, 9311443 |
2450 |
Chachapoyas |
|
P3 |
204063, 9314146 |
2473 |
Chachapoyas |
|
P4 |
210394, 9323565 |
2941 |
Chachapoyas |
|
P5 |
184266, 9310253 |
2326 |
Chachapoyas |
|
P6 |
61712.6, 774156.3 |
2340 |
Chachapoyas |
|
P7 |
61703.7, 773945.6 |
2580 |
Chachapoyas |
|
P8 |
62325.8, 7759 20.4 |
2602 |
Luya |
|
P9 |
181885, 9289095 |
1836 |
Luya |
|
P10 |
181623, 9274009 |
2478 |
Luya |
|
P11 |
167108.403, 9355710.34 |
2494 |
Bongará |
|
P12 |
184997, 9307683 |
2427 |
Chachapoyas |
|
P13 |
186430, 9274262 |
2004 |
Luya |
|
P14 |
187292, 9275825 |
1996 |
Luya |
2.5. Análisis estadístico
Se utilizó un modelo metodológico mixto en el que se integró el enfoque cualitativo y cuantitativo para establecer la correlación entre la variable dependiente e independientes. Para determinar si existe alguna diferencia entre las medias de los diferentes grupos se realizó el análisis de varianza y la prueba de T, Test con un intervalo de confianza del 95 %. Se realizó una prueba Tukey HSD de comparaciones múltiples para medir el grado de lesión por cada muestra de truchas en cada piscigranja. La correlación de Spearman se usó para medir la asociación de los parámetros físico-químicos del agua, el manejo y las lesiones encontradas en las muestras de trucha en cada piscigranja. Para el análisis estadístico de datos se utilizó el software Statistix versión 8.0 Analytical Software para Windows.
3. RESULTADOS Y DISCUSIÓN
Uno de los parámetros importantes es la temperatura del agua, ya que regula el desarrollo de la especie acuícola (FAO, 2014). Las truchas pueden vivir en unos rangos de temperatura entre 13 y 18ºC, siendo el óptimo 15 ºC (Besson et al., 2016). En nuestro estudio los rangos de temperaturas fluctuaron entre 11.82 y 17.04ºC, si bien es cierto, cuatro piscigranjas reportaron temperaturas inferiores a 13 °C, estos valores no se alejaron en exceso. Las piscigranjas inferiores en este parámetro fueron la P4 (T = 11.82ºC), P5 (T = 12.7ºC), P10 (T = 12.99ºC) y P11 (T = 12.99ºC), siendo la P4 la más lejana al mínimo valor recomendable (1.18°C). Se ha reportado, que los salmónidos dependiendo de la variedad o característica genética pueden tolerar temperaturas inferiores al optimo recomendado, dependiendo de la carga y su taza metabólica, probablemente las truchas de nuestra investigación se han adaptado a estas condiciones de temperatura (Hansen et al., 2015) (Tabla 2).
En cuanto al pH, todos los valores obtenidos, a excepción de la primera piscigranja (P1) se situaron dentro de los límites reportados en estudios previos; los mismos que sugieren un rango optimo entre 6.5 y 8.5 (Erikson et al., 2017). La piscigranja P1 reportó un valor de 4.35, calificándose como de aguas acidas. Se sabe que, en condiciones de acidez se producen irritación en las branquias, descamación de la piel e hipoxia (Vásquez et al., 2015). Por otra parte, valores de pH mayores de 8 afectan negativamente la salud de la trucha causando el daño de las branquias (Svobodova et al., 2017). En nuestro estudio, encontramos que existe correlación altamente significativa entre las lesiones encontradas y el pH; observado en la piscigranja P1.
La concentración de oxígeno disuelto se reporta en la tabla 2, se observa que cinco piscigranjas P1 (OD = 3.98 mg/L), P2 (OD = 4.69 mg/L), P3 (OD = 4.24 mg/L), P5 (OD = 3.70 mg/L) y P13 (OD = 4.84 mg/L), exceden el rango recomendado para la producción de trucha, oscila entre 7.5 y 12.0 mg/L, siendo el promedio óptimo 8.5 (Gammons et al., 2010); sin embargo, en nuestro estudio, no se encontró una asociación entre las lesiones y el oxígeno disuelto.
Tabla 2. Resultados para los parámetros físico-químicos y microbiológicos evaluados en las piscigranjas
|
Piscigranja |
Parámetros |
||||
|
Coliformes fecales (NMP/ml) |
(pH) |
T (C°) |
O.D (mg/l) |
SDT (ppm) |
|
|
P1 |
49 |
4.35 |
16.59 |
3.98 |
8 |
|
P2 |
680 |
6.59 |
16.71 |
4.69 |
25 |
|
P3 |
110 |
7.39 |
17.04 |
4.24 |
80 |
|
P4 |
130 |
7.85 |
11.82 |
5.76 |
96 |
|
P5 |
79 |
7.35 |
12.7 |
3.7 |
119 |
|
P6 |
70 |
7.8 |
13.68 |
7.76 |
126 |
|
P7 |
4600 |
6.94 |
14.1 |
5.16 |
13 |
|
P8 |
2100 |
7.8 |
13.68 |
7.76 |
126 |
|
P9 |
11000 |
7.97 |
15.9 |
7.32 |
119 |
|
P10 |
23 |
7.05 |
12.98 |
5.86 |
62 |
|
P11 |
13000 |
7.94 |
12.99 |
6.25 |
167 |
|
P12 |
48000 |
6.91 |
14.94 |
5.95 |
26 |
|
P13 |
350000 |
7.81 |
14.03 |
4.84 |
87 |
|
P14 |
920 |
7.36 |
13.2 |
7.09 |
93 |
P: Piscigranja. NMP: número más probable. pH: potencial de hidrogeno. T: temperatura. O.D: oxígeno disuelto. SDT: solidos totales en suspensión.
La concentración de coliformes fecales se observa en la figura 2, las piscigranjas P1, P3, P4, P5, P6 y P10, están por debajo de los límites máximos permitidos (200 NMP/ml), según lo establecido por los Estándares Nacionales de Calidad Ambiental (ECAs) del Agua, (MINAM, 2017). Lo cual nos permite coincidir con lo dicho por (Olsen et al., 2012; Valenzuela et al., 2012) quienes afirman que los presencia de coliformes fecales se asociación a la presencia de ganado en las cercanías a las piscigranjas; ya que las quebradas que proveen el recurso hídrico tienen recorrido por zonas ganaderas e incluso población humana que eliminan las heces, purines y estiércol al agua, aumentando así los niveles de esta bacteria.
Según lo establecido por los Estándares Nacionales de Calidad Ambiental (ECAs) del Agua, (MINAM, 2017), la categoría 2 establece que, para la extracción y cultivo de especies hidrobiológicas en aguas continentales, el límite máximo permitido para coliformes fecales es de 200 NMP/ml; al comparar nuestros resultados obtenidos con estos estándares, solo seis (P1, P3, P4, P5, P6 y P10) están por debajo de los límites máximos permitidos para este parámetro.
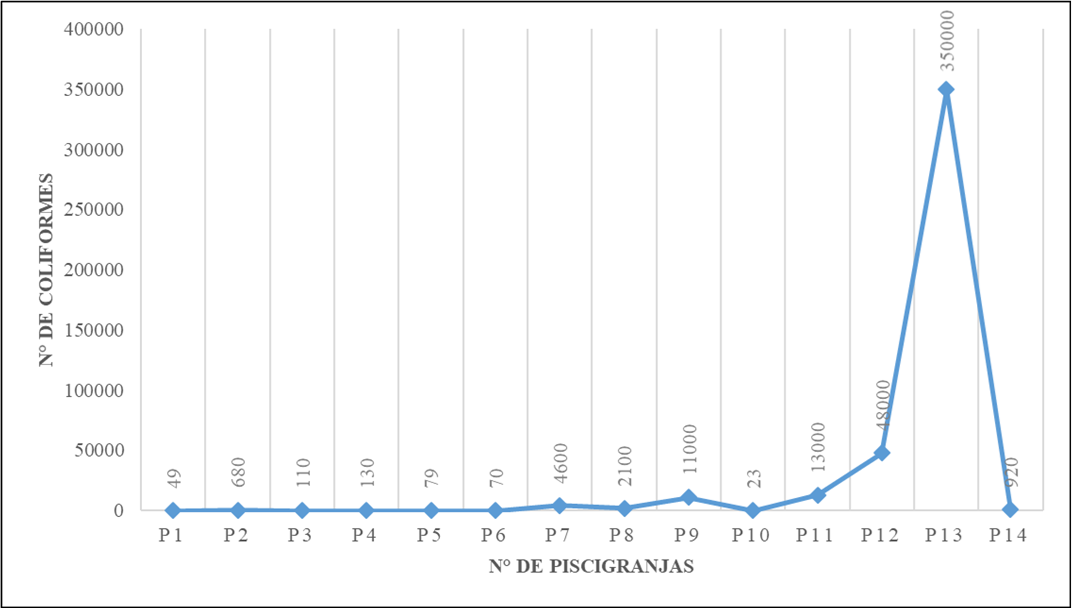
Figura 2. Número de coliformes fecales por piscigranja.
Las lesiones en las diferentes zonas anatómicas de los peces representan el manejo sanitario de las especies acuáticos siendo esto un factor importante en el éxito productivo.
Con respecto a las lesiones que presentaron las truchas arcoíris en nuestra investigación, se registraron que los mayores porcentajes fueron de 37.14 % para erosión de la aleta dorsal y 17.9% para erosión en la aleta caudal; siendo superior a lo reportado en una investigación en la ciudad de Junín, ( 1.2 %) para la aleta caudal y dorsal; por el contrario, dicho estudio reportó valores superiores en atrofia en aleta pectoral (10.9%) y exoftalmia bilateral (3%), en comparación a los nuestros (1.4 % y 1.43%) respectivamente (Llerena, 2007).
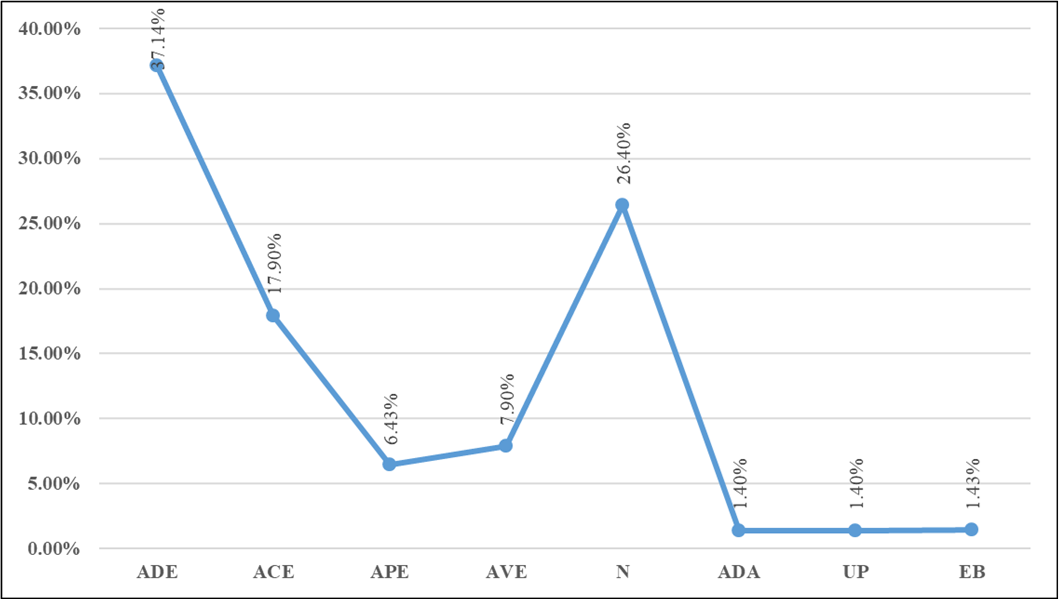
Figura 3. Frecuencia de las lesiones encontradas en las truchas. ADE: Aleta dorsal con erosión; ACE: Aleta caudal con erosión; APE: Aletas pectorales con erosión; AVE: Aletas ventrales con erosión; N: Normal; ADA: Aleta dorsal atrofiada; UP: Ulceras en la piel; EB: Exoftalmia bilateral.
Existen diferencias altamente significativas entre las piscigranjas con respecto a las lesiones presentes en las truchas.
El análisis de correlación según Spearman reporta que los parámetros pH, temperatura y turbidez, evidencian una asociación altamente significativa con las lesiones presentadas, por lo tanto, se puede deducir que, a mayor temperatura, turbidez y pH, las truchas arcoíris presentarán mayores lesiones (Tabla 3).
La correlación entre las prácticas de manejo (limpieza, frecuencia, desinfección de instalaciones y desinfección de materiales y herramientas) y las lesiones (Tabla 4).

Figura 4. Erosión de las aletas pélvicas.

Figura 5. Erosión de la aleta caudal.
Tabla 3. Correlación entre las lesiones identificadas y los parámetros físico-químicos del agua
|
Variables |
Correlación de Spearman |
Conclusión |
|
|
rS |
p |
||
|
Lesiones/pH |
-0.039 |
0.0006 ** |
Altamente significativa |
|
Lesiones/Temperatura del agua |
0.3095 |
0.0002** |
Altamente significativa |
|
Lesiones/Oxígeno disuelto |
0.083 |
0.3294ns |
No hay correlación |
|
Lesiones/SDT |
0.2417 |
0.0041 |
Altamente significativa |
Ns: No significativo. *: significativo. **: altamente significativo.
Tabla 4. Correlación entre las lesiones y las prácticas de manejo
|
Variables |
Correlación de Spearman |
Conclusión |
|
|
rS |
p |
||
|
Lesiones/Limpieza de las instalaciones |
-0.3677 |
0.0000** |
Altamente significativa |
|
Lesiones/Frecuencia de limpieza de las instalaciones |
0.3627 |
0.0000** |
Altamente significativa |
|
Lesiones/Desinfección de instalaciones |
-0.5412 |
0.0000** |
Altamente significativa |
|
Lesiones/ Frecuencia de desinfección de las instalaciones |
0.2859 |
0.0006** |
Altamente significativa |
|
Lesiones/ Desinfección de materiales y herramientas de manejo |
-0.1903 |
0.0245* |
Asociación significativa |