

Efecto del fotoperiodo en las truchas (Oncorhynchus mykiss) sobre la maduración gonadal para inducir al desove fuera de estación reproductiva
Effect of photoperiod in trout (Oncorhynchus mykiss) on gonadal maturation to induce spawning outside the breeding season
Dilmer Roca1,a,*, Lisbeth N. Manrique1,b, Washinton H. Boza1,c
1 Grupo Industrial IMPERIUS JABSA SAC. Huancavelica, Perú.
a Bach.,
![]() remlid_rdd@hotmail.com,
remlid_rdd@hotmail.com, ![]() https://orcid.org/0000-0002-8214-5806
https://orcid.org/0000-0002-8214-5806
b Ing., ![]() lisnatames@gmail.com,
lisnatames@gmail.com, ![]() https://orcid.org/0000-0001-6202-3214
https://orcid.org/0000-0001-6202-3214
c Bach., ![]() inghector30@gmail.com,
inghector30@gmail.com, ![]() https://orcid.org/0000-0003-0200-5529
https://orcid.org/0000-0003-0200-5529
* Autor de Correspondencia: Tel. +51 937352283
http://dx.doi.org/10.25127/riagrop.20231.897
Resumen
El objetivo de esta investigación fue evaluar el fotoperiodo con luz artificial en las truchas (Oncorhynchus mykiss) para la maduración sexual de las gónadas. Se trabajó con 240 reproductoras de 3 años, de segundo desove, que fueron sometidas al fotoperiodo con luz artificial. Los tratamientos fueron T0 con luz natural, T1 con 18HL:6H0 (fotoperiodo largo) y el T2 con 18HO:6HL (fotoperiodo corto), durante 6 meses. Se utilizó la energía fotovoltaica para cada cámara oscura, adaptada previamente. A los 3 meses, se realizó el cambio de fotoperiodo para el T1, fotoperiodo horas luz corto y T2 fotoperiodo de horas luz largo. La evaluación del desarrollo gonadal se realizó de manera manual mediante masajes ventrales en dirección opérculo-caudal. Cuando se obtuvieron las ovas maduras, se procedió a realizar el proceso de fertilización. Para ello, se utilizó semen de neomachos que fueron madurados con diferentes medios maduración, por 2 horas a 4 °C. Posteriormente, se realizó la fertilización a partir de ciertos parámetros. Los resultados no evidencian diferencias significativas (p<0.05) entre los tratamientos. Sin embargo, si la época de desove fue en diferentes meses para los tratamientos, para ambos tratamientos y en el testigo no se encontró óvulos maduros. Con respecto los siguientes parámetros número de ovas, volumen de ovas, total de ovas y el diámetro de ovas no fueron influenciados significativamente por los tratamientos (p-valor>0.05). Sin embargo, encontró una diferencia significativa que utilizaron diferentes medios maduración (p-valor<0.05).
Palabras claves: Fotoperiodo; inducción maduración; ovas; reproductoras.
Abstract
The objective was to evaluate the photoperiod with artificial light in trout (Oncorhynchus mykiss) for the sexual maturation of the gonads. We worked with 240 3-year-old breeders, all of them from second spawning, who were subjected to the photoperiod with artificial light, the treatments were, T0 with natural light, T1 was 18HL:6H0 (long photoperiod) and T2 18HO:6HL (short photoperiod). for 6 months. Photovoltaic energy was used for each previously adapted dark chamber. After 3 months, the photoperiod was changed to T1 short light-hour photoperiod and T2 long light-hour photoperiod. For the evaluation of gonadal development, it was carried out manually, performing ventral massages in the operculo-caudal direction, once the mature eggs were obtained, the fertilization process was carried out, for which nemomacho semen was used, which were matured with different media. maturation for 2 hours at 4° C. then fertilization was carried out taking into account certain parameters. The results do not show significant differences (p<0.05) between the treatments. But if the spawning season was in different months for the treatments for both treatments and in the control no mature ovules were found, while with respect to the following parameters number of eggs, volume of eggs, total number of eggs and diameter of eggs were not significantly influenced by the treatments (p-value>0.05), however, a significant difference was found using different maturation media (p-value<0.05).
Keywords: photoperiod, maturation induction, eggs and breeders.
1. INTRODUCCIÓN
En la actualidad, para conseguir un buen sistema de producción sostenible de truchas, es necesario superar el problema de la escasez de insumo biológico (ovas y alevines), que se da durante la mayor parte del año. Este factor limita la producción permanente de este recurso que no permite adquirir y comercializar su producto en períodos del año muy restringidos. Además, no permite satisfacer las demandas, siempre crecientes, de la industria acuícola que necesita un suministro continuo de huevos y larvas a lo largo de todo el año. Los peces, gracias a su flexibilidad de adaptación, son capaces de sincronizar sus ritmos biológicos con las fluctuaciones periódicas ambientales para optimizar los recursos existentes. Sin embargo, una manipulación adecuada de los parámetros ambientales también puede alterar sus ritmos biológicos y ponerlos al servicio de la industria acuícola (Bromage et al., 2001; Imsland, et al., 2003; Begtashi et al., 2004; Norberg et al., 2004; Migaud et al., 2006).
En este sentido, se conoce un método y la eficacia del mismo en la obtención de ovas durante cualquier época del año, que utilizan para ello la variación del fotoperiodo que estimula la maduración sexual de la trucha. Este “producto” resulta altamente atractivo para las empresas del sector acuicultor, debido a que en la actualidad existe alto interés por parte de estos, para lograr el abastecimiento continuo a lo largo del año de ovas nacionales (Ingle et al., 2012).
La manipulación del fotoperiodo, en el cultivo de peces, es utilizada a fin de modificar el ciclo reproductivo, mejorar la sincronía de la maduración sexual, inducir el desove e incluso resolver problemas de sobrepoblación (Kissil et al., 2001).
Estas modificaciones pueden ser generadas mediante variaciones de luz sobre la glándula pineal y el hipotálamo. Ambas glándulas secretan y sintetizan hormonas reproductivas, como la hormona liberadora de gonadotropina, el estradiol, la progesterona y la testosterona, que regulan el desarrollo gonadal en los peces (Prayogo et al., 2012). Para eliminar la estacionalidad del desove en truchas, por periodos definidos en diferentes épocas del año, se posibilita el adelanto y atraso del desove e inducir la maduración en cualquier época del año. Además, las variaciones del fotoperiodo influyen en el comportamiento social y uso de energía de los peces, así como la disponibilidad y consumo de alimento. De forma similar, los periodos de luz producen variaciones en la liberación de la hormona melatonina de la hipófisis, responsable de la inhibición (Carrillo et al., 2009), de la liberación de hormonas de la glándula pituitaria y la expresión de los genes GnRH3 y GnRH-R2a del cerebro y glándula pituitaria. El Objetivo de la investigación fue evaluar el efecto del fotoperiodo en las truchas (Oncorhynchus mykiss) sobre la maduración gonadal para inducir al desove fuera de estación reproductiva.
2. MATERIALES Y MÉTODOS
2.1. Lugar de estudio
El estudio se realizó en la región Huancavelica, en las instalaciones de la piscigranja de la empresa Grupo Industrial Imperius JABSA SAC, ubicado en Badopampa a una distancia de 7 km del distrito de Palca a una altitud 3650 m s. n. m., con coordenadas 12° 39’ 15” de latitud sur y 74° 58’ 45” de longitud oeste.
2.2.1. Determinar el efecto del tiempo de exposición a la luz en la inducción a la maduración sexual
Se trabajó con un total 240 reproductoras de 3 años de edad. De estos, se selccionaron 20 reproductoras al azar y distribuidas en cada circular. Se tuvo 3 tratamientos con 4 repeticiones. Para el caso de los testigos (T0), estos fueron sometidos a un fotoperiodo natural, mientras tratamiento 1 (T1) con fotoperiodo largo fueron sometidos a luz artificial 18 horas de luz y 6 horas de oscuridad (18L:6O). Por otro lado, en el tratamiento 2 (T2), se sometieron fotoperiodo de días cortos de 6 horas de luz y 18 horas de oscuridad (6L:18O), por un periodo de 6 meses (Díaz y Neira, 2004).
2.2.2. Acondicionamiento de los estanques
Se acondicionó 8 estaques circulares de fibra de vidrio para el T1 y T2. Para la cámara oscura, se colocó unas tapas en forma cónica que estuvieron elaboradas a base de tubos y que fueron cubiertas con plástico negro y malla arpillera.
2.2.3. Acondicionamiento y adaptación de ambientes controlados
Para la aplicación del fotoperiodo, la energía fue a base de un sistema fotovoltaico con energía solar. Para la parte interna, se utilizó luces fluorescentes aéreos y sumergibles de color blanco de 18 watts.
2.2.4. Frecuencia y tiempo de evaluación de las reproductoras
Se aplicó el fotoperiodo durante 6 meses. A los 3 meses, las reproductoras fueron evaluadas para observar el desarrollo de las gónadas. Posteriormente, se realizó el cambio del fotoperiodo a los tratamientos el T1 fue sometido al fotoperiodo corto (6L:18O) y el T2 fotoperiodo largo (18L: 6O). Al quinto mes, se realizó la evaluación cada 15 días para ver el estado de maduración de las gónadas (maduración de óvulos).
2.2.5. Determinar el proceso de la ovogénesis, de los tratamientos sometido a fotoperiodo largo, corto y natural
Para la evaluación de las reproductoras, solo se escogieron las hembras aptas para la reproducción que habían llegado a madurar por completo sus gónadas (óvulos) o lista para desovar.
2.2.6. Extracción de gametos masculinos
Para le recuperación de semen, se utilizó neomachos de 3 años de edad, que fueron revertidos sexualmente, mediante andrógenos artificiales. La selección se realizó fenotípicamente con desarrollos de los belfos en el maxilar inferior y la coloración iridiscente en los flancos.
Los neomachos seleccionados fueron sometidos a ayuna durante 24 horas. Los individuos fueron sacrificados. A continuación, se realizó una incisión en la parte media ventral, se identificó los testículos y se extrajo con la precaución de no romperlo (Estay et al., 1988). La obtención del semen se realizó mediante las técnicas de goteo. Por otro lado, las gónadas fueron cortadas longitudinal y transversalmente y se colocaron en tubos falcón.
2.2.7. Proceso de maduración seminal
El proceso de maduración se realizó con el protocolo descrito por Robles et al. (2003). Las muestras se sometieron a 4 ºC/2 h, en refrigeración la relación semen 1: 9 medio de maduración SP TALP, SP TALP suplementado, LAHNISTER, TRIS y sin medio.
2.2.8. Proceso de fertilización
Para obtener las ovas, se realizó manualmente, con masajes ventrales en dirección opérculo-caudal. Los cuales fueron depositados en recipiente de plástico de color blanco. Seguidamente, se roció el semen maduro con una concentración espermática de 8 x 106 espermatozoides /móviles /ova. Con una jeringa, se tomó 7 ml semen y se roció las ovas. Con la ayuda de una pluma, se removió y se dejó por un tiempo de 3 a 5 minutos.
Finalmente, se agregó 200 ml de solución fisiológica al 7 %. Estos fueron rotulados de acuerdo al medio que se utilizó.
2.2.9. Conteo de huevos
Se realizó bajo el método de Von Bayer, que consiste en colocar en fila tantos huevos. Posteriormenste, se contó el número de huevos. Esta operación se repitió 3 veces y se obtuvo un valor promedio, que se ingresó a la tabla de Von Bayer, y se determinó la cantidad de huevos total en una unidad de volumen.
2.2.10. Siembra de los huevos fertilizados
Cuando las ovas se fertilizaron, se realizó el lavado varias veces. Seguidamente, con la ayuda de una probeta, se medió el volumen y se realizó la siembra de 6000 mil ovas por bastidor.
2.3. Análisis estadístico
Los resultados fueron analizados mediante el Análisis de Varianza, con un nivel de confianza de 95% y la prueba Tukey para comparaciones multiples.
3. RESULTADOS Y DISCUSIÓN
3.1. Resultados obtenidos con la aplicación de fotoperiodo
Tabla 1. Resultados de la Aplicación del Fotoperiodo
|
Proporciones (IC) de truchas desovadas según tratamiento |
|||
|
Tratamiento |
Enero |
Febrero |
Marzo |
|
T1 |
81.25 (72.7-89.80)a |
0.00 (0.00-0.00)b |
0.00 (0.00-0.00)b |
|
T2 |
0.00 (0.00-0.00)b |
55.00 (44.1-65.9.00)a |
16.25 (8.17-24.33)a |
|
TESTIGO |
0.00 (0.00-0.00)b |
0.00 (0.00-0.00)b |
0.00 (0.00-0.00)b |
Letras diferentes en la misma columna, indican diferencias significativas a la prueba de proporciones (p<0.05)
Los resultados, con la aplicacion del fotoperiodo a las reproductoras expuestas a fotoperiodo largo (18L:6O) T1, mostraron diferencia estadísticamente significativa con respecto al T2 en los meses de ovulación. Con respecto al fotoperiodo natural, las gónadas aún se encontraban en desarrollo T0. Mientras que se observó que el grupo sometido a fotoperiodo largo y corto, adelantó el periodo de desove un mes antes con respecto al grupo sometido fotoperiodo corto y después largo.
En la figura 1, se observa que el mayor porcentaje de desove fue en el mes de enero con 81.25 % respecto al T1. Sin embargo, en T2 se puede observar que en febrero de desove es 55 % y marzo 16.25 %. se pude decir que tratamientos de fotoperiodos se presentó diferencia entre los meses de ovulación fuera de la época del desove.
De acuerdo a la aplicación del fotoperiodo, según resultados (Ingle et al.,2012), mostraron diferencia estadísticamente significativa en los días de ovulación con respecto a los otros dos tratamientos experimentales de fotoperiodo largo y corto, mientras que nuestros resultados igualmente se encontró diferencia significativa con la aplicación de fotoperiodo y la maduración. El desove, con respecto al T1, fue en la época de enero.
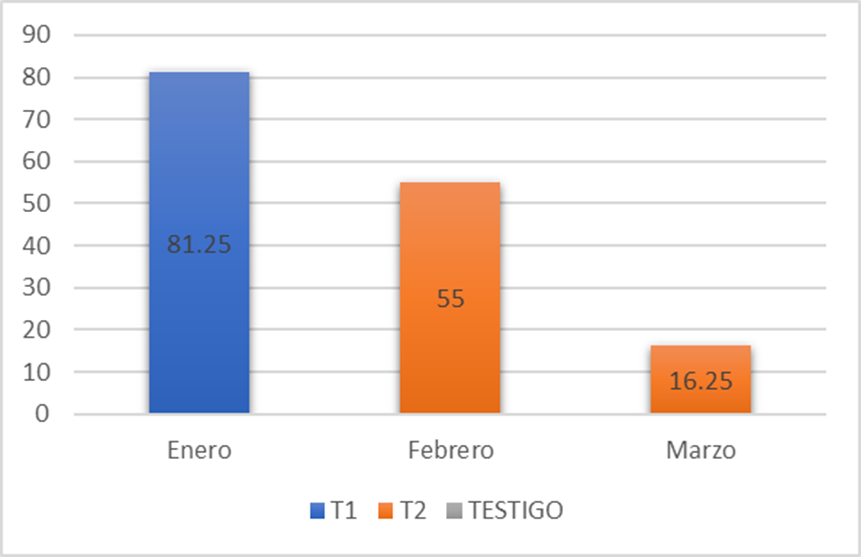
Figura 1. Porcentaje de truchas desovadas, por tratamiento y mes.
Por otro lado, Salamanca (2020) mostró una investigación con respecto al maduración de las gónadas que mostraron diferencia significativa con la aplicación de diferentes tratamientos de fotoperiodo, para el tratamiento, T1 (testigo) muestra un 33.3 % de reproductores no aptos para su reproducción, distintos del tratamiento T2 fotoperiodo corto (18O:6L) en donde se muestra un 20 % de no aptos para reproducirse y un 13.3 % de reproductores aptos para su reproducción. Sin embargo, el tratamiento fotoperiodo largo T3 (18L:6O) se muestra un 3.33 % de no aptos para reproducirse y un 30 % de reproductores aptos para su reproducción
En oncorhynchus mykiss, se obtuvieron adelantos significativos de la fecha de desove con la utilización de regímenes de luz continua, según argumenta Bon et al. (1997), a diferencia de Bourlier y Billard (1984) que reporta un retraso de desove, que se logró con luz continua. En contraste, Ingle et al. (2012) sostienen que los reproductores expuestos a luz continua (18L:6O) mostraron diferencia estadísticamente significativa en los días de ovulación, con respecto a los reproductores expuestos a fotoperiodo natural.
En relación al marco teórico de la presente investigación, y de un análisis de tipo experimental, Carrillo et al. (2009) indican que, en salmónidos, la gametogénesis es facilitada por fotoperiodos largos, por lo que se reflejan los resultados óptimos en el T3 (fotoperiodo largo). Además, Migaud et al. (2006) señalan que la glándula pineal es la responsable de las fluctuaciones rítmicas de melatonina, una hormona clave en la percepción del día y la noche de los peces, y que influye en la mayor parte de procesos fisiológicos, entre ellos, la reproducción.
3.2. Resultados de las características de las ovas según el fotoperiodo aplicado
Las ovas obtenidas de los tratamientos del fotoperiodo, según los resultados de la tabla 2 (en cuanto a los siguientes parámetros: número de ovas, volumen de ovas, total de ovas y el diámetro de ovas), no fueron influenciados significativamente por los tratamientos (p-valor>0.05). Es decir, que las variables mencionadas son similares tanto para el tratamiento T1 como para el tratamiento T2.
Tabla 2. Resultados de los Tratamientos de Fotoperiodo
|
Características de ovas (EE) según tratamiento del fotoperiodo |
|||||
|
Factor |
n |
Número de ovas (n) |
Volumen de ova (ml) |
Total de ovas (mil) |
Diámetro de ova (mm) |
|
Tratamiento |
[0.2011] |
[0.8141] |
[0.4231] |
[0.1635] |
|
|
T1 |
46 |
64.61 (0.15)a |
377.83 (3.29)a |
4196.53 (50.25)a |
4.73 (0.01)a |
|
T2 |
50 |
64.3 (0.18)a |
378.8 (2.55)a |
4145.6 (39.37)a |
4.75 (0.01)a |
|
Total |
96 |
64.45 (0.12) |
378.33 (2.05) |
4170.01 (31.57) |
4.74 (0.01) |
Entre corchetes, p-valores para el efecto de los tratamientos; Superíndices diferentes en la misma columna y dentro de cada factor indican diferencias significativas a la prueba de Tukey (p<005).
Así mismo, Ingle et al. (2012) encontraron diferencia en el diámetro de huevo poshidratación. Los registros más altos fueron del tratamiento perteneciente a fotoperiodo natural y los registros menores pertenecieron al tratamiento de fotoperiodo avanzado.
Por otro lado, Salamanca (2020) evidenció los resultados de total de 7095 unidades ovas de 04 semovientes hembras de edad adulta. Sin embargo, Mantilla (2004) menciona que la puesta de la cantidad de ovas es 1600 a 3300 unidades de óvulos / 450 g en sus dos primeros años. Por tanto, se puede afirmar que estos resultados fueron diferentes a obtenidos en la presente investigación. Todo ello debido a que la reducción de puesta de la cantidad de ovas es causada por efectos como: fotoperiodo sobreimpuesto, stress, alimentación y edad del pez.
En cuanto al diámetro de las ovas para el T1 fue 4.73 mm y en T2 de 4.75mm. Ambos tratamientos fueron similares a lo reportado por Lagler (1984) quien argumenta que las ovas llegan, generalmente, a medir entre los 4 y 5 mm.
3.3. Resultados de fertilidad del fotoperiodo mediante medios de maduración
Según los resultados de la tabla 3, en cuanto al porcentaje de fertilidad, el tratamiento del fotoperiodo en los diferentes parámetros (mortalidad de ovas y el porcentaje de ovas fertilizadas) no fueron influenciados de manera significativa por el tratamiento ni tampoco por el medio de maduración (p-valor>0.05). En cambio, la prueba realizada de fertilidad a los 12 días, en relación al número de ovas embrionadas y el porcentaje de ovas embrionadas, fue afectada significativamente por el tratamiento y el medio de maduración (p-valor<0.05). El número de ovas embrionadas y el porcentaje de ovas embrionadas fueron superiores en el tratamiento 2 (T2) a la prueba de Tukey (p-valor>0.05). Este número fue mayor en ovas embrionadas y el porcentaje de ovas embrionadas según los resultados se mostraron con el medio de maduración SP-TALP-SUP 72.67 %; seguida de SP-TALP 64.86 % y LAHNTEINER 64.56 % (quienes no fueron diferentes entre sí); seguido del medio TRIS 52.44 %. En cambio, la menor cantidad de ovas embrionadas y porcentaje de ovas embrionadas se consiguió Sin-Medio de maduración 33.18 % (p-valor<0.05).
Tabla 3. Resultados de Fertilización por Tratamientos del Fotoperiodo
|
Fertilización de ovas del fotoperiodo |
|||||
|
Factor |
n |
Mortalidad de ovas (n) |
Ovas fertilizadas (%) |
Número de ovas embrionadas (n) |
Porcentaje de ovas embrionadas (%) |
|
Tratamiento |
[0.8827] |
[0.61454] |
[<2e-16] |
[<2e-16] |
|
|
T1 |
46 |
617.76 (11.62)a |
85.28 (0.21)a |
21 (1.19)b |
42 (2.39)b |
|
T2 |
50 |
615.59 (9.48)a |
85.14 (0.2)a |
26.72 (0.97)a |
53.44 (1.95)a |
|
Medio de Maduración |
[0.1566] |
[0.09411] |
[<2e-16] |
[<2e-16] |
|
|
LAHNTEINER |
18 |
602.32 (16.29)a |
85.61 (0.27)a |
32.28 (0.46)b |
64.56 (0.93)b |
|
SIN-MEDIO |
49 |
611.82 (10.48)a |
85.41 (0.19)a |
16.59 (0.16)d |
33.18 (0.32)d |
|
SP-TALP |
14 |
605.17 (18.51)a |
84.71 (0.46)a |
32.43 (0.45)b |
64.86 (0.91)b |
|
SP-TALP-SUP |
6 |
663.54 (30.77)a |
84.83 (0.48)a |
36.33 (0.42)a |
72.67 (0.84)a |
|
TRIS |
9 |
657.98 (21.8)a |
84.33 (0.53)a |
26.22 (0.49)c |
52.44 (0.99)c |
|
Total |
96 |
616.63 (7.4) |
85.21 (0.14) |
23.98 (0.82) |
47.96 (1.63) |
*Entre corchetes, p-valores para el efecto de los factores; Superíndices diferentes en la misma columna y dentro de cada factor indican diferencias significativas a la prueba de Tukey (p<005).
Los resultados obtenidos de mortalidad, durante la fecundación, fueron similares entre los tratamientos que se reportan en un 617.76 para el T1 y el 615.59 T2. Sin embargo, Orna (2015) describe los porcentajes de mortandad en un 14 %, durante la incubación y un 10 % en la fase larval.
En ese sentido, Ingle et al. (2012) reportaron que no se encontró diferencia significativa (p<0.05) en la fecundación, entre los tratamientos de fotoperiodo avanzado 2,444 óvulos/kg y natural 2,398 óvulos/kg. Del mismo modo, en el presente trabajo de investigación, en la fecundación, no se encontró diferencia significativa entre los T1 (85.28 %) y T2 (85.14 %).
En el proceso de maduración del semen del neomacho, los resultados encontrados fueron mejores por medio de maduración SP TALP suplementado 72.67 %. Por tanto, se puede afirmar que el proceso de maduración tuvo un efecto significativo sobre el porcentaje de fertilidad. Estos resultados fueron similares a los reportados por Valconez (2010) que utilizó un medio de maduración que contenía glucosa y metanol al 10 % como crioprotector. El porcentaje de fertilización obtenido fue del 69.25 %. Por otro lado, Mustafa y Tulin (2020) reportaron una fertilidad de un 87,1 ± 4,9 % y 87,5 ± 5,3%, con un medio suplementario de maduración como BSA, HEPES y antioxidantes.
4. CONCLUSIONES
La aplicación del fotoperiodo de días largos, seguido del fotoperiodo de días cortos, induce a la maduración de las gónadas y a la ovulación fuera de la época reproductiva de las hembras de trucha arco iris.
La fecundación no es afectada por la aplicación de la técnica para la manipulación del fotoperiodo.
Declaración de intereses
Ninguna.
Agradecimientos
Los autores expresan su agradecimiento al Programa Nacional de Innovación en Pesca y Acuicultura (PNIPA), Universidad Nacional de Huancevelica, Empresa Imperius JABSA SAC y empresa TECNOVA EIRL, por permitirnos llevar acabo la presente investigación en el proyecto denominado “Obtención de ovas embrionadas monosexas de truchas (Oncorhynchus mykiss) aplicando la biotecnología reproductiva y modificando la época de desove mediante regulación del fotoperiodo con el uso de energía fotovoltaica en el distrito de Palca - región de Huancavelica”.
A la Escuela Académico Profesional de Zootecnia de la Universidad Nacional de Huancavelica por permitirnos compartir los conocimientos con los estudiantes y docentes.
Referencias
Begtashi, I., Rodríguez, L., Molés, L., Zanuy, S. & Carrillo, M. (2004) Long-termexposure to continuous Light inhibits precocity in juvenile male European sea bass (Dicentrarchus labrax, L.). I. Morphological aspects. Aquaculture 241: 539-559.
Bon, E., Corraze, G., Kaushik, S. & Le Menn, F. (1997). Efectos de los regímenes acelerados de fotoperíodo en el ciclo reproductivo de la trucha arcoiris 78 hembra: I - Las variaciones estacionales de los lípidos plasmáticos se correlacionan con la vitelogénesis. Bioquímica y fisiología comparada: una fisiología, 118 (1), 183-190
Bourlier, A. y Billard, R. (1984). Retraso de la gametogénesis y el desove por la iluminación constante de la trucha arcoiris (Salmo gairdneri) durante el primer ciclo reproductivo. Canadian Journal of Zoology , 62 (11), 2183–2187
Bromage, N., Porter, M., & Randall, C. (2001). The Environmental Regulation of Maturation in Farmed finfi sh with special reference to the role of photoperiod and melatonin. Aquaculture 197: 63-98. https://doi.org/10.1116/S0044-8486 (01)00583-X.
Carrillo M. et al. (2009). La Reproducción de Los Peces Aspectos básicos y sus aplicaciones en acuicultura. Fundación observatorio español de acuicultura consejo superior de investigación científicas ministerio de medio ambiente y medio rural y marino. Madrid, 719.
Carrillo, M., Zanuy, S., Felip, A., Bayarri, M.J., Moles, G. & Gómez, A. (2009). Hormonal and environmental control of puberty in perciform fish. Ann. N.Y. Acad. Sci. Doi: 10.1196/annals. 1388.047.
Díaz, N.F. & Neira, R. (2004). Biotecnología Aplicada a La Acuicultura I. Biotecnologías Clásicas Aplicadas a La Reproducción de Especies Cultivadas. Cie. Invest. Agraria (Chile).
Estay, F., Neira, R., Diaz, N.F., Valladares, L. & Torres, A. (1988).Gametogenesis and sex steroid profiles in cultured coho salmon (oncorbyncbus kisutcb, walbaum) J.Exp.Zool.280:429-438
Imsland, A.K., Dragsnes, M. & Stefansson, S. (2003). Exposures to continuos light inhibits maturation in turbot (Scopthalmus maximus). Aquaculture 219: 911-919.
Ingle, G., Montero. M., Salas, A. & Mora, I., (2012) INAPESCA, “Proceso de adaptación, validación, transferencia y adopción de la tecnología, para la producción de huevo de trucha arco iris (Oncorhynchus mykiss) fuera de estación mediante la manipulación de fotoperiodo” 1, 28
Kissil G., Lupatsch, I., Elizur, A. & Zohar, Y. (2001). Long photoperiod delayed spawning and increased somatic growth in gilthead seabream (Sparus aurata). Aquaculture 200: 363-379.
Lagler, K.F., Bardach, J.E., Miller, R.R. & May, D.R. (1984) Ictiología, Editorial AGT, México, 27-91.
Lahnsteiner, F., Berger, B. & Weismann, T. (1999). Metabolismo del esperma de los peces teleósteos Chalcalburnus chalcoides y Oncorhynchus mykiss y su relación con la motilidad y viabilidad. Exp. J. Zool. 284, 454–465. https://doi.org/10.1002/(SICI)1097.
Migaud H., Taylor J.F., Taranger G.L., Davie A., Cerdá-Reverter J.M., Carrillo M., Hansen, T. & Bromage N.R. (2006). A comparative ex vivo and in vivo study of day and night perception in teleost species using the melatonin rhythm. J. Pineal Res. 41, 42–52.
Mustafa, H. & Tulin , A. (2020). The comparison and improvement of artificial media used for the maturation of testicular sperm of rainbow trout neomales. aquaculture, 25. doi:https://doi.org/10.1016/j.aquaculture.2020.736115
Norberg, B., Brown, C.L., Halldorsson, O., Stensland, K. & Björnsson, B.J. (2004) Photoperiod regulates the timing of sexual maturation, spawning, sex steroid and thyroid hormone profi les in Atlantic cod (Gadus morhua). Aquaculture 229: 451-467.
Prayogo N.A., Wijayanti G.E., Murwantoko, Kawaichi, M. & Astuti, P. (2012). Effect of photoperiods on melatonin levels, the expression of cGnRH-II and sGnRH genes and estradiols level in hard-lipped barb (Osteochilus hasselti C.V.). Global veterinaria 8: 591-597.
Robles, V., Cabrita, E., Cuñado, S. & Herráez, M.P. (2003). Sperm cryoprervation of sex reserved rainbow trout (Oncorthynchus mykiss): Parameters that affect its ability for freezing. Aquaculture, 224: 203-212.
Salamanca D., (2020) Inducción a la Maduración Sexual y Desove de oncorhynchus mykiss Trucha arco Iris” por Fotoperiodo en el CIPBS – Chucuito, una Puno” Tesis de pregrado.
Tello, J.A. (2010) Efecto del fotoperiodo y la temperatura en el crecimiento y determinación sexual del pez blanco de patzcuaro (menidia estor)- (Tesis de pregrado), Mexico.
Valconez, M.E. (2010). Criopreservacion de semen para neomachos de truchas Oncorthynchus mykisss en el proyecto de mejoramiento genético. Facultad de Ingenieria en Biotecnologia.ESPE.Sede Sangolqui, 84.
