

Relación de los
niveles de testosterona sérica y el tamaño testicular en alpacas según grupo
etario y mes del año en Tacna, Perú
Relationship of
serum testosterone levels and testicular size in alpacas according to age group
and month of the year in Tacna, Peru
Daniel
Gandarillas1,a,*, Edith A. Torres1,b, Abel E. Quispe1,c,
Rosarios M. Rios1,d, Angelina Puma1,e
1 Universidad
Nacional Jorge Basadre Grohmann, Tacna, Perú.
a Dr.,  dgandarillase@unjbg.edu.pe,
dgandarillase@unjbg.edu.pe,  https://orcid.org/0000-0002-9435-6344
https://orcid.org/0000-0002-9435-6344
b Med. Veter y
Zoot.,  etorresh@unjbg.edu.pe,
etorresh@unjbg.edu.pe,  https://orcid.org/0000-0002-9222-1657
https://orcid.org/0000-0002-9222-1657
c Med. Veter y
Zoot.,  abel_2990@yahoo.com,
abel_2990@yahoo.com,  https://orcid.org/0000-0002-5485-1113
https://orcid.org/0000-0002-5485-1113
d Med. Veter y
Zoot.,  rriosb@unjbg.edu.pe,
rriosb@unjbg.edu.pe,  https://orcid.org/0000-0001-5583-7121
https://orcid.org/0000-0001-5583-7121
e Med. Veter y
Zoot.,  apumai@unjbg.edu.pe,
apumai@unjbg.edu.pe,  https://orcid.org/0000-0002-3762-2394
https://orcid.org/0000-0002-3762-2394
* Autor de
Correspondencia: Tel. +51 998557631
http://dx.doi.org/10.25127/riagrop.20223.845
 Resumen
Resumen
El objetivo del presente
estudio fue evaluar la relación del tamaño testicular con los niveles de
testosterona sérica en alpacas según la edad y mes del año. Se trabajó con ocho
machos
(4 jóvenes y 4 adultos). Las mediciones del tamaño testicular se realizaron con
una regla Vernier y la determinación de los niveles de testosterona
en suero se realizó mediante una prueba de quimioluminiscencia. Los adultos
presentaron mayor tamaño testicular en los meses de abril, octubre, noviembre y
en jóvenes en abril y noviembre. Así mismo, se encontró una diferencia
significativa (t=3.17; p=0.009) entre adultos (8.41 cm2) y jóvenes
(6.57 cm2). Con relación al nivel de testosterona, tanto en adultos
y jóvenes, los niveles más altos fueron en el mes de abril. La comparación
entre jóvenes y adultos no presentó diferencias significativas (t=0.23;
p=0.81). Además, la concentración de testosterona no presentó una relación
significativa con el largo (r = 0.41), ancho (r
= 0.21) y área testicular (r = 0.32).
Palabras
claves: camélidos, edad, hormona.
Abstract
The aim of this study
was to evaluate the relationship between testicular size and serum testosterone
levels in alpacas according to age and month of the year. Eight males were used
(4 young and 4 adults). Measurements of testicular size were performed using a
Vernier rule and determination of serum testosterone levels was performed using
a chemiluminescence test. The adults presented greater testicular size in the
months of April, October, November and in young people in April and November;
likewise, a significant difference (t = 3.17; p=0.009) was found between adults
(8.41 cm2) and young males (6.57 cm2). The testosterone
level in adults showed a significative difference (H = 13.29; p = 0.02) between
months, being highest in April and September and lowest in July and October. In
young males there was also a significant difference between months (H = 13.78;
p=0.02), being highest in April and lowest in July, August and October. The
testosterone level in adults (1.66 ng/ml) and young (1.45 ng/ml) was
statistically similar (t = 0.23; p=0.81). Furthermore, the testosterone
concentration did not show a significant relationship with the length (r =
0.41), width (r = 0.21) and testicular area (r = 0.32).
Keywords: camelid, age,
hormone.
1.
INTRODUCCIÓN
Los camélidos tienen características reproductivas únicas que, a
menudo, ocasionan un pobre rendimiento reproductivo comparado con otras
especies domésticas (Brown, 2000). Las dimensiones testiculares constituyen un
importante indicador en la evaluación del potencial reproductivo del macho y
puede ser empleado como criterio para predecir la producción diaria de semen,
debido a la elevada correlación existente entre la medición escrotal, el peso
testicular y la producción total de semen (Bravo et al., 2000). Además,
el tamaño testicular puede verse afectado por la época del año, siendo mayor en
verano que en invierno (Urquieta et al., 1994).
Se ha reportado que los niveles de testosterona están asociados a
la fertilidad (Waheed et al., 2015). Esta hormona es responsable de la
espermatogénesis y el comportamiento sexual. Por lo tanto, el patrón estacional
de la secreción de testosterona podría limitar la eficiencia reproductiva
durante algunos periodos del año (Todini et al., 2007). Un aumento de
los niveles séricos se relaciona con la libido sexual y con la edad (Deen,
2008; Swelum et al., 2018), así como con los cambios estacionales
(El-Harairy y Attia, 2010; Bravo, 2013).
En otras especies domesticas como en el bovino (Mokhtar et al.,
2019) y en el caprino (Vega et al., 2001), existe una correlación entre
el tamaño testicular, edad y los niveles séricos de testosterona. Sin embargo,
en camélidos no se han reportado una relación tácita entre estas dos variables,
pero se menciona un aumento del tamaño testicular y de la concentración de
testosterona a lo largo del año (Urquieta et al., 1994). Se dispone de
escasos estudios sobre la biología reproductiva de las alpacas macho en
comparación con otras especies de interés productivo; por esta razón, se
propuso evaluar la relación del tamaño testicular y los niveles de testosterona
sérica de alpacas macho según la edad y los meses del año.
2.
MATERIALES Y MÉTODOS
El estudio se llevó a cabo en el Laboratorio de Reproducción
Animal de la Universidad Nacional Jorge Basadre Grohmann, en la provincia y distrito
de Tacna, Perú, a una altitud de 599 m. La temperatura en la zona fluctúa entre 22 y 30
°C, en verano, y entre 10 y 24 °C, en invierno. El estudio se realizó durante los meses de abril (otoño),
julio-agosto (invierno) y setiembre-noviembre (primavera).
Se seleccionaron ocho alpacas
machos Huacaya. Cuatro de ellas eran jóvenes (2-3 años) y cuatro adultos (3-5
años) y con un historial de fertilidad, mantenidos bajo una crianza estabulada.
La alimentación fue a base de heno de alfalfa y avena, según las necesidades
nutricionales de los animales, además de acceso ad libitum de agua.
Las medidas testiculares (largo y ancho de cada testículo) se realizaron
mensualmente con una regla Vernier. Se colectaron muestras de sangre mediante
venopunción yugular, con tubos Vacutainer con anticoagulante, se
centrifugaron a 3500 rpm x 10 min para obtener el suero, los cuales fueron
almacenados a 2-8 °C hasta su análisis. Para la determinación de testosterona
sérica, se tomaron alícuotas de 100 µl cada suero y se analizaron mediante la
prueba de quimioluminiscencia (CLIA) con un equipo
semiautomatizado Lumatic (Monobind 4400).
Se determinó la asociación entre el nivel de testosterona y el
largo, ancho y área testicular mediante la prueba de correlación múltiple de
Spearman por tratarse de muestras con distribución no normal. Las comparaciones
del nivel de testosterona, entre jóvenes y adultos a través de los meses, se
realizaron con la prueba no paramétrica de Kruskal Wallis. Los análisis se
realizaron con el programa Sigmaplot 11.0 (Systat Software, 2008).
3. RESULTADOS
Y DISCUSIÓN
3.1.
Tamaño testicular, edad y mes
El tamaño de los testículos, en alpacas adultas y jóvenes según el
mes del año, se presenta en la figura 1. El tamaño testicular fue mayor en los
meses de abril, octubre y noviembre, tanto en jóvenes como en adultos, en
tanto, el área testicular fue mayor en abril, julio y noviembre. En ambos
grupos etarios, los testículos fueron más pequeños en agosto y más grandes en
abril y noviembre. Asimismo, se encontró diferencia significativa (t=3.17,
p=0.009) entre adultos (8.41 cm2) y jóvenes (6.57cm2).
Estos resultados son similares a los reportados en camellos
adultos que presentaron mayor tamaño testicular, durante los meses de verano,
en comparación con los de invierno (Al-Bulushi et al., 2019). Así mismo
en vicuñas adultas, se observó un mayor diámetro longitudinal y transversal en
febrero y menor en agosto (Urquieta et al., 1994). Este incremento se
debe, principalmente, al aumento del diámetro de los túbulos seminíferos y
secundariamente por el incremento del volumen total del tejido intersticial
(Hochereau-de Reviers et al., 1993).
Las variaciones estacionales podrían atribuirse a factores como
desarrollo corporal, tipo de forraje, y medio ambiente. Por otro lado, el mayor
tamaño testicular de los adultos se debe a que los testículos presentan un
crecimiento lento pero constante a partir de los 6 meses y hasta los 36 meses
(Pacari y Delgado, 2012; Bravo, 2013).
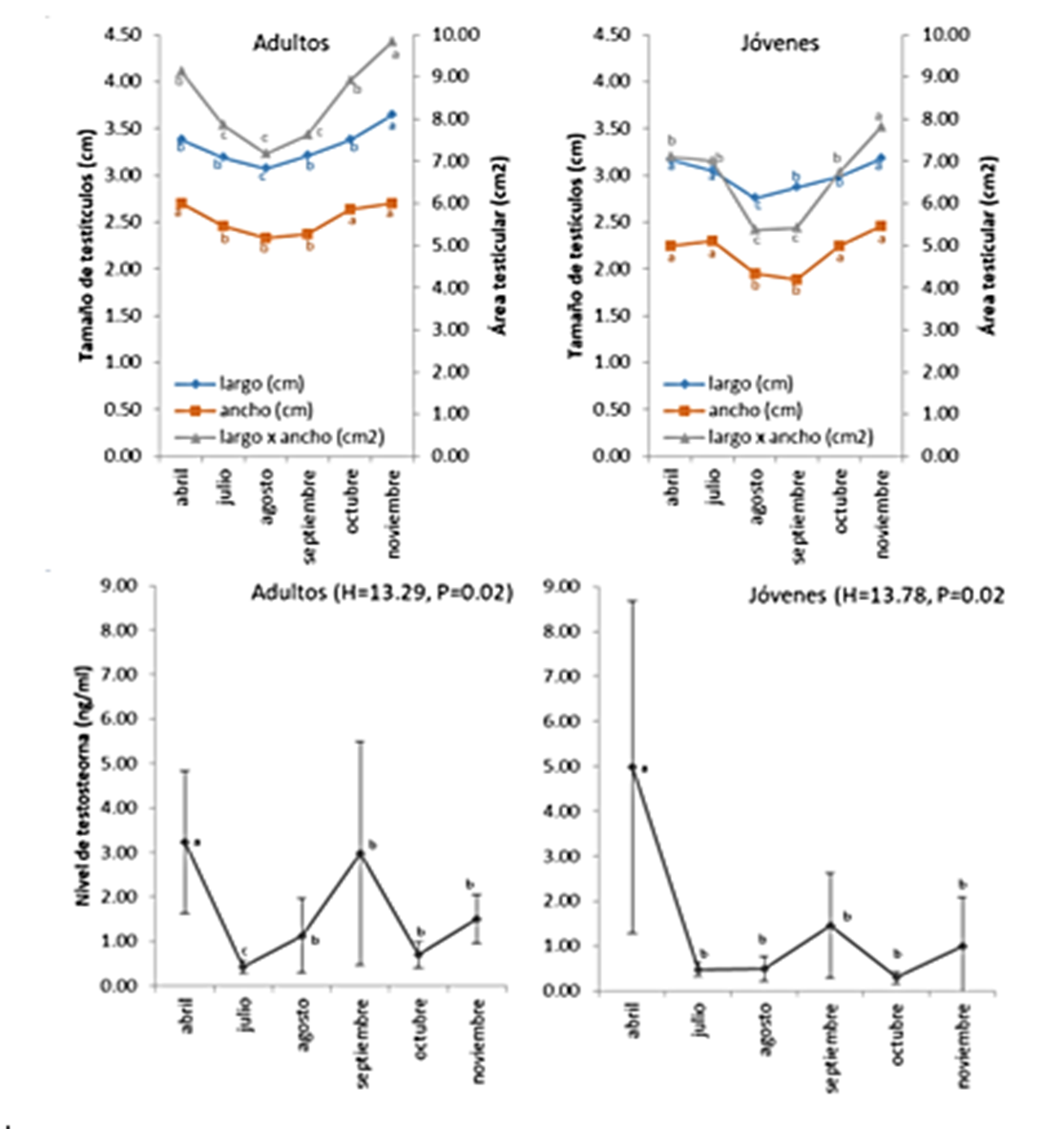
Figura 1. Tamaño
testicular y nivel de testosterona en alpacas adultas (n=4) y jóvenes (n=4)
según el mes del año.
3.2.
Testosterona sérica según edad
y mes
Los niveles de testosterona en adultos, a lo largo de los meses,
presentaron una variación (Figura 1: H=13.29, p=0.02) y fue en abril el pico
más alto el valor y el más bajo en julio. En jóvenes, de igual manera, se
presentó el pico más alto en el mes de abril y más bajos en julio, agosto y
octubre (H=13.78; p=0.02). El nivel de testosterona entre en adultos (1.66
ng/ml) y jóvenes (1.45 ng/ml) no mostró diferencia significativa (t=0.23;
p=0.81).
El presente estudio mostró una mayor concentración de testosterona
sérica en abril y septiembre, en jóvenes y adultos. En este sentido, Bravo
(2013) reporta una mayor concentración de testosterona en la temporada de
primavera y menor en invierno. Así mismo, Urquieta et al., (1994)
encontraron mayor concentración de testosterona en febrero frente a agosto, en
tanto que en cabritos del Mediterráneo se encontró una mayor concentración en
verano y menor en invierno (Todini et al., 2007).
3.3.
Tamaño testicular y testosterona
sérica
La figura 2 muestra la relación del tamaño
testicular y los niveles de testosterona sérica. Los resultados indican que el
tamaño de testículos y nivel de testosterona de adultos y jóvenes no están
relacionados con el largo (r = 0,41), ancho (r = 0,21) y área testicular (r =
0,32) y solo coinciden en el mes de abril, cuando los testículos alcanzan mayor
tamaño y los niveles de testosterona son elevados.
Los resultados encontrados en este estudio son
contrarios a lo reportado por Al-Bulushi et al. (2019), en camellos (r= 0,98); Mokhtar et al.
(2019), en toros Brown Atlas (r = 0,73); Milczewski et al (2015) en
carneros de raza Suffolk (r = 0,59) y (r = 0.58) Zamiri et al (2010), donde encuentran una relación entre estos dos
variables. Por ello, estos autores resaltan la importancia de las dimensiones
testiculares, porque constituye un indicador en la evaluación del potencial
reproductivo del macho y podría ser empleado como criterio para predecir la
producción diaria de semen. Estas diferencias pueden ser atribuidas a los
factores como el manejo, el medio ambiente, temperatura, la alimentación o el
tipo de forraje que consumían los animales en el lugar de estudio. Gleen et
al. (1991) mencionan que en toros alimentados con altos niveles de energía
digerible, se incrementa el espesor escrotal por la disposición de lípidos y
presentaron una reducción espermática a comparación a los que tuvieron una
alimentación bajo en niveles de proteína.
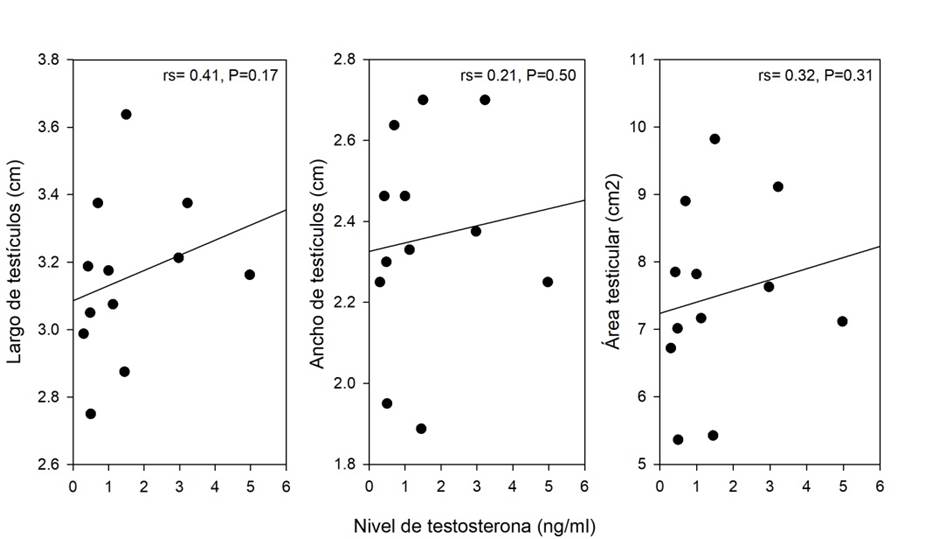
Figura
2. Relación entre nivel de testosterona
(ng/ml) y el tamaño de testículos (cm2) en adultos y juveniles.
4. CONCLUSIONES
Se encontraron variaciones significativas en tamaño testicular y
niveles de testosterona por efecto de la edad (adultos y jóvenes) y meses del
año, pero no se encontró una relación significativa entre estas dos variables.
Declaración
de intereses
Ninguna.
Agradecimientos
Los autores expresan su agradecimiento a la Universidad Nacional
Jorge Basadre Grohmann y al Proyecto “Uso de la biotecnología para el
mejoramiento genético y desarrollo de capacidades en el manejo de alpacas (Vicugna
pacos) en la zona altoandina de Tacna” por el financiamiento a través de
fondos del canon, sobre canon y regalías mineras.
Referencias
Al-Bulushi,
S., Manjunatha, B., Graaf, S. & Rickard, J. (2019). Reproductive
Seasonality of Male Dromedary Camels. Animal Reproduction Science, 202:
10-20. doi:10.1016/j.anireprosci.2018.12.013.
Bravo,
P., Skidmore, J.A. & Zhao. X. (2000). Reproductive Aspects and Storage of
Semen in Camelidae. Animal Reproduction Science, 62: 173-93. doi:10.1016/S0378-4320(00)00158-5
Bravo,
P.W. (2013). Llama and Alpaca Care: Medicine, Surgery, Reproduction, Nutrition,
and Health: First Edition Reproductive Anatomy and Physiology in the Male. Elsevier
Inc. doi:10.1016/B978-1-4377-2352-6.00015-8.
Brown,
B.W. (2000). A Review on Reproduction in South American Camelids. Animal
Reproduction Science, 58: 169-195. doi:10.1016/S0378-4320(99)00081-0
Deen,
A. (2008). Testosterone Profiles and Their Correlation with Sexual Libido in
Male Camels. Research in Veterinary Science, 85(2): 220-226. doi:10.1016/j.rvsc.2007.10.012
El-Harairy,
M.A. & Attia, K.A. (2010). Effect of Age, Pubertal Stage and Season on
Testosterone Concentration Concentration in Male Dromadary Camel. Saudi
Journal of Biological Sciences 17(3): 227-301. doi: 10.1016/j.sjbs.2010.04.006.
El
Allali, K., Achaaban, M.R., Vivien-Roels, B., Bothorel, B., Tligui, N.S.,
Pévet, P. & Pévet, P. (2005). Seasonal variations in the nycthemeral rhythm
of plasma melatonin in the camel (Camelus dromedarius). Journal of Pineal
Research, 39(2), 121–128. doi: 10.1111/j.1600-079X.2005.00224.x
Hochereau
de Reviers, M.T., Locatelli, A., Perreau, C. & Setchell, B. (1993).
Seminiferous Tubules in Hypophysectomized Rams Treated with Pituitary. Journal
of Reproduction and Fertility, 97, 381-387. doi: 10.1530/jrf.0.0970381
Milczewski,
V. et al. (2015). Quantifying the Effect of Seasonality on Testicular
Function of Suffolk Ram in Lower Latitude. Small Ruminant Research, 124:
68-75. doi:10.1016/j.smallrumres.2014.12.012
Mokhtar,
R.M., Hamiroune, M., Hammadi, M., Fatnassi, M., Lamia, D. & Berber, A.
(2019). Étude des relations entre circonférence scrotale, testostérone sérique
et âge chez des bovins mâles bruns de l’Atlas en Algérie. Livestock
Research for Rural Development, 31. http://www.lrrd.org/lrrd31/12/moura31193.html
Pacari,
M. & Delgado, P. (2012). Evaluación de la temperatura y tamaño testicular
en llamas (lama glama) en cinco diferentes edades. Resúmenes y Trabajos VI
Congreso Mundial de Camélidos Sudamericanos, 2012, pp. 152-153.
Swelum,
A., Saadeldim, A., Hani Ba-Awadh, I.A. & Alowaimer, A. (2018). Shortened
Dily Photoperiod during the Non-Breeding Season Can Improve the Reproductive
Performance of Camel Bulls ( Camelus Dromedarius). Animal Reproduction
Science, 195: 3334-44. doi: 10.1016/j.anireprosci.2018.06.014.
Todini,
L., Malfatti, A. & Giuseppina, M. (2007). Seasonality of Plasma
Testosterone in Males of Four Mediterranean Goat Breeds and Three Different
Climatic Conditions. Theriogenelogy, 67(3): 627-31. doi:
10.1016/j.theriogenology.2006.09.023
Urquieta,
B., Cepeda, R., Cáceres, J.E., Raggi, L.A & Rojas, J.R. (1994). Seasonal
Variation in Some Reproductive Parameters of Male Vicunña in the High Andes of
Northem Chile. Journal of Arid Environments, 26(1): 79-87. doi: 10.1006/jare.1994.1012
Vega,
A.C., Ruiz, R. & Oscar, R. (2001). Relación de la circunferencia escrotal
con algunos parámetros de calidad seminal en caprinos Criollos de la provincia
de Tucuman (Argentina). Bioline International, 19 (3),
455-463.
Waheed,
M.M., Ghoneim, L.M. & Alhaider, A.K. (2015). Seminal Plasma and Serum
Fertility Biomarkers in Dromedary Camels (Camelus Dromedarios). Theriogenology,
83(4): 650-54. doi: 10.1016/j.theriogenology.2014.10.033.
Zamari,
M.J., Khalili, B., Jafaroghli, M. & Farshad, A. (2010). Seasonal Variation
in Seminal Parameters, Testicular Size, and Plasma Testosterone Concentration
in Iranian Moghani Rams. Small Rumiant Research, 94(3): 132-36. doi:10.1016/j.smallrumres.2010.07.013


![]() dgandarillase@unjbg.edu.pe,
dgandarillase@unjbg.edu.pe, ![]() https://orcid.org/0000-0002-9435-6344
https://orcid.org/0000-0002-9435-6344
![]() etorresh@unjbg.edu.pe,
etorresh@unjbg.edu.pe, ![]() https://orcid.org/0000-0002-9222-1657
https://orcid.org/0000-0002-9222-1657 ![]() abel_2990@yahoo.com,
abel_2990@yahoo.com, ![]() https://orcid.org/0000-0002-5485-1113
https://orcid.org/0000-0002-5485-1113 ![]() rriosb@unjbg.edu.pe,
rriosb@unjbg.edu.pe, ![]() https://orcid.org/0000-0001-5583-7121
https://orcid.org/0000-0001-5583-7121 ![]() apumai@unjbg.edu.pe,
apumai@unjbg.edu.pe, ![]() https://orcid.org/0000-0002-3762-2394
https://orcid.org/0000-0002-3762-2394 

