

Patogenicidad in vitro de Beauveria peruviensis en hembras adultas de garrapatas Rhipicephalus microplus
In vitro pathogenicity of Beauveria peruviensis in adult female Rhipicephalus microplus ticks.
Viviana Zumaeta1,a,*, William Bardales1,b, Segundo Oliva2,c
1 Facultad de Ingenieria Zootecnista, Agronegocios y Biotecnología, Universidad Nacional Toribio Rodríguez de Mendoza de Amazonas, Chachapoyas, Perú.
3 Instituto de Investigación para el Desarrollo Sustentable de Ceja de Selva, Universidad Nacional Toribio Rodríguez de Mendoza de Amazonas, Chachapoyas, Perú.
a Bach.,
![]() vizua1998@gmail.com,
vizua1998@gmail.com, ![]() https://orcid.org/0000-0003-0266-3214
https://orcid.org/0000-0003-0266-3214
b M.Sc., ![]() william.bardales@untrm.edu.pe,
william.bardales@untrm.edu.pe, ![]() https://orcid.org/0000-0001-9721-9057
https://orcid.org/0000-0001-9721-9057
c
M.Sc.,
![]() soliva@indes-ces.edu.pe,
soliva@indes-ces.edu.pe, ![]() https://orcid.org/0000-0002-9670-0970
https://orcid.org/0000-0002-9670-0970
* Autor de Correspondencia: Tel. +51 957954074
http://dx.doi.org/10.25127/riagrop.20222.822
Resumen
La presente investigación se realizó con el objetivo de evaluar la patogenicidad in vitro del hongo Beauveria peruviensis sobre garrapatas Rhipicephalus microplus, en estadio de teleoginas. En el bioensayo, se sometió a tratamientos con soluciones del hongo Beauveria peruviensis en concentraciones de 1x109, 1x108 y 1x107 conidios / mL, donde se evaluó la mortalidad de teleoginas, inhibición de la ovoposición. Como resultado, se obtuvo una mortalidad de 92 %, 80 % y 64 %. En cuanto a la inhibición de la ovoposición, esta fue del 60%, 32% y 16% con los tratamientos 1x109, 1x108 y 1x107 conidios / mL respectivamente. La prueba de Dunnet indicó que todos los tratamientos muestran una diferencia significativa con el testigo, con un nivel de confianza del 99.95 %. En conclusión, el hongo Beauveria peruviensis es patógeno para Rhipicephalus microplus en el estadio de teleoginas.
Palabras claves: Beauveria peruviensis, conidios, in vitro, patogenicidad, Rhipicephalus microplus, oviposición.
Abstract
The present investigation was carried out with the objective of evaluating the in vitro pathogenicity of the fungus Beauveria peruviensis on Rhipicephalus microplus ticks in the teleogynous stage. In the bioassays, it was subjected to treatments with solutions of the fungus Beauveria peruviensis in concentrations of 1x109, 1x108 and 1x107 conidia / mL, where the mortality of teleogynes, inhibition of oviposition was evaluated. As results, a mortality of 92%, 80% and 64% was obtained; Regarding the inhibition of oviposition, it was 60%, 32% and 16% with the treatments 1x109, 1x108 and 1x107 conidia / mL, respectively. Dunnet's test indicates that all treatments show a significant difference with the control, using a confidence level of 99.95%, in conclusion, the fungus Beauveria peruviensis is pathogenic for Rhipicephalus microplus in the teleogine stage.
Keywords: Beauveria peruviensis, conidia, in vitro, pathogenicity, Rhipicephalus microplus, oviposition.
1. INTRODUCCIÓN
La ganadería bovina es una importante actividad económica en el mundo. En el Perú, representa el 3.2 % del Valor Bruto de Producción (Minagri, 2017) e involucra a pequeños productores. Esta actividad se realiza en todos los departamentos del país y destacan, dentro de ellos, los lugares con condiciones climáticas de trópico, como la región de Amazonas, San Martin, Ucayali, Loreto y Huánuco, en donde se encuentra el 11.18 % de la población (INEI, 1994).
Las garrapatas son el principal problema de la ganadería tropical y subtropical, ya que son transmisores de agentes patógenos causante de piroplasmosis y anaplasmosis, que llegan a causar hasta la muerte de los animales. Rhipicephalus microplus (anteriormente Boophilus microplus) es la garrapata que tiene un mayor impacto económico en México, Centroamérica, Suramérica y Australia, donde las pérdidas económicas se reflejan en la baja ganancia de peso, daño en las pieles, disminución de la producción de carne y leche, y en la transmisión de enfermedades zoonóticas (Echevarry y Osorio, 2016).
El principal método de control de la garrapatosis es el control químico a base de cipermetrinas, ivermectinas, organofosforados, entre otros, de los que, con el paso del tiempo, los parásitos han generado resistencia. Los métodos de control químico, además de la resistencia del parásito mismo, traen consigo peligros para la salud de las personas, animales y del ambiente. Esto posibilita la utilización de métodos alternativos de control. Uno de ellos es el control biológico.
El control biológico fue concebido a inicios del siglo XIX, cuando algunos naturistas de diferentes países reseñaron el importante papel de los organismos entomófagos, en la naturaleza y con el empleo de estos controladores biológicos se intenta restablecer el perturbado equilibrio ecológico, mediante la utilización de organismos vivos para eliminar o reducir los daños causados por organismos perjudiciales. Actualmente, se desarrollan agentes de control biológico, organismos vivos como hongos, bacterias, virus e insectos que reducen la población de insectos y enfermedades, sin dañar el medio ambiente y la salud (Guédez et al., 2008).
El control biológico, mediante el uso de hongos entomopatógenos, ha demostrado ser una alternativa promisoria y económicamente prometedora para el control de garrapatas en los bovinos. Los hongos entomopatógenos destacan como una alternativa de control biológico de garrapatas en la ganadería bovina gracias a su amplia distribución natural, bajo riesgo para la salud de humanos y animales, compatibilidad ambiental, alta virulencia sobre garrapatas y bajo costo. Los hongos del género de Beauveria en los últimos años se están usando como controladores biológicos efectivos de muchas plagas, entre ellas las garrapatas y no manifiesta problemas asociados con el uso de productos químicos (Fernández, 2006).
El género Beauveria se considera un género de hongos cosmopolita anamórfico y teleomórfico transmitidos por el suelo, patógenos de artrópodos que incluye especies ecológicas y económicamente importantes (Bustamante et al., 2019).
El control biológico de garrapatas en la ganadería bovina, con el uso de hongos entomopatógenos del género Beauveria, es una práctica sanitaria que se desarrolla como una alternativa al control químico de los ixodicidas y, con ello, se contribuye a reducir la resistencia que generan los tratamientos con productos químicos. El mecanismo específico de acción de los hongos entomopatógenos es principalmente por contacto: el hongo es capaz de penetrar dentro del insecto e invadirlo para provocar la muerte (Delgadillo et al., 2007).
A la enfermedad producida por el hongo se la conoce como micosis y se desarrolla en tres fases. La primera es la adherencia y germinación del hongo, donde las esporas que germina forman un tubo germinativo que funciona como una hifa de penetración de la cutícula, además, infecta a las garrapatas a través de la abertura corporales, como la cavidad bucal y el ano. La segunda fase es la penetración por parte de las hifas por la degradación enzimática de la cutícula y la presión mecánica ejercida por el tubo germinativo. Por último, la tercera fase comienza con el desarrollo del hongo que tiene como resultado la muerte de la garrapata (Pucheta, 2006).
El hongo Beauveria peruviensis es un hongo entomopatógeno descubierto a partir del análisis de una serie de especies de hongos del género Beauveria, aislados de cepas fúngicas de barrenadores de café infectados (Hypothenemus hampei), obtenidos de bayas de café infectadas en los cafetales en el noreste de Perú (provincia de Rodríguez de Mendoza, departamento de Amazonas), a partir de observaciones morfológicas, inferencias filogenéticas y métodos de delimitación de especies de ADN. La clasificación taxonómica de Beauveria peruviensis corresponde al Reino Fungi, Clase Sordariomycetes, Familia Clavicipitacea, Género Beauveria (Instituto de Investigación de Sanidad Vegetal, 1998), Especie: Beauveria peruviensis (Oliva Cruz, 2019).
El trabajo de investigación se inició con la colecta de las garrapatas Rhipicephalus microplus, en hatos ganaderos infestados del distrito de Lonya Grande, provincia de Utcubamba, sin tratamiento químico o biológico para garrapatas en un periodo mínimo de un mes. Posteriormente, fueron trasladadas al Laboratorio de Enfermedades Infecciosas y Parasitarias de Animales Domésticos (LABISAN) perteneciente a la Facultad de Ingeniería Zootecnista, Agronegocios y Biotecnología de la Universidad Nacional Toribio Rodríguez de Mendoza de Amazonas, que se encuentra en la provincia y distrito de Chachapoyas, para el desarrollo de todo el proceso de investigación.
Para realizar la inoculación de las garrapatas, previamente se realizó la desinfección y selección de las mismas. Se preparó al hongo Beauveria peruviensis, en las concentraciones 1x109, 1x108 y 1x107 conidios / ml fue colocado en vasos beaker. Las inoculaciones se realizaron por el método de inmersión (se sumergió las garrapatas por un periodo de 3 minutos). Las muestras se mantuvieron en incubación a temperatura de 28 °C y observadas por un periodo de 7 días.
El presente trabajo de investigación tuvo como objetivo evaluar la patogenicidad de Beauveria peruviensis en el control de garrapatas Rhipicephalus microplus y se consideró la necesidad de desarrollar mecanismos de control biológico de la garrapata (Rhipicephalus microplus) en los hatos ganaderos del país, para lograr contribuir a la mejora económica de las familias mediante la sostenibilidad productiva y reproductiva a través del tiempo.
2. MATERIALES Y MÉTODOS
2.1. Muestras y lugar de estudio
En el presente trabajo de investigación se colectaron garrapatas Rhipicephalus microplus adultas de ganado bovino infestado, ubicados en hatos ganaderos del distrito de Lonya Grande. Los animales a los cuales se les colectaron las garrapatas no recibieron control químico ni biológico en un periodo mínimo de 30 días. El mecanismo de retiro de las garrapatas se realizó con el uso de pinzas que evitaron lesionar a la misma a fin de garantizar su viabilidad.
El hongo Beauveria peruviensis fue proporcionado por el Instituto de Investigación para el Desarrollo Sustentable de Ceja de Selva (INDES-CES).
2.2. Manejo de las garrapatas Rhipicephalus microplus.
Las garrapatas colectadas fueron colocadas en tapers ventilados y luego trasladadas al Laboratorio de Enfermedades Infecciosas y Parasitarias de Animales Domésticos (PROSAN) de la Universidad Nacional Toribio Rodríguez de Mendoza de Amazonas, ubicado en la provincia y distrito de Chachapoyas.
En laboratorio, se seleccionaron garrapatas mayores a 4 milímetros y para el bioensayo se consideró según López et al. (2009).
2.3. Preparación de la solución de hongo Beauveria peruviensis
Para la activación del hongo, se realizó la siembra del hongo Beauveria peruviensis en medio nutritivo agar papa dextrosa (APD) e incubación a 25 ºC ± 2, durante 20 días. Con las esporas obtenidas de la cepa en el medio APD (figura 1), se realizó una nueva siembra en seis bolsas plástica de polipropileno que contenían arroz precocido (figura 3), se amarró, esterilizó y luego se incubaron durante 20 días a 25 ºC ± 2 (Requejo, 2019).
Una vez que las cepas esporularon sobre el arroz, se determinó la concentración de esporas con ayuda de la metodología de Cañedo y Ames (2004). Para esto, se preparó
una dilución seriada con el hongo Beauveria peruviensis en concentraciones de 1x107, 1x108 y 1x109 conidios/ml. De acuerdo con las fórmulas empleadas, se determinó la cantidad de esporas (g) y el volumen (mililitros) de agua destilada para las distintas concentraciones. Las concentraciones se determinaron a partir de los antecedentes de investigaciones realizadas en el de control de garrapatas con otras especies o géneros de hogos entomopatógenos (Angelo et al. 2009).

Figura 1. Hongo Beauveria peruviensis activado y esporulado en PDA.
2.4. Patogenicidad in vitro de la Beauveria peruviensis en garrapatas teleoginas.
Para la prueba de patogenicidad en el laboratorio, se siguió el procedimiento descrito por González et al. (1993). Se tomaron las garrapatas en estado de teleoginas, seleccionadas para este bioensayo y se desinfectaron con hipoclorito de sodio al 0,5 %. Posteriormente, se las sumergió durante 3 minutos, luego se lavaron 3 veces con agua destilada estéril (ADE) y posteriormente se formaron 4 grupos de 25 garrapatas para cada uno de los tratamientos: T1 (1x107, conidios/ml), T2 (1x108, conidios/ml), T3 (1x109 conidios/ml) y Tratamiento testigo (agua destilada).
Las garrapatas se inocularon por inmersión durante 3 minutos en vasos beaker que contenían 50 ml de solución de cada una de las concentraciones preparadas, T1 (1x107, conidios/ml), T2 (1x108, conidios/ml), T3 (1x109, conidios/ml) y los individuos del tratamiento testigo en agua destilada. Luego, con ayuda de una pinza, se distribuyeron las 25 garrapatas de cada tratamiento en 5 placas petri de cristal de 90 mm de diámetro, previamente esterilizadas y acondicionadas con papel filtro humedecido, por cada tratamiento (5 individuos por placa) y se procedió a identificarlas con el código de la concentración y el nombre de cada bioensayo. Para el tratamiento testigo las garrapatas, se colocaron en una solución de agua destilada estéril y se procedió a distribuir las 25 garrapatas en 5 placas petri (5 individuos por placa). Las muestras fueron colocadas en la incubadora a una temperatura de 28 °C y se realizó una observación diaria hasta la mortalidad de todos los individuos, la cual se alcanzó a los 6 días posteriores a la inoculación.
2.5. Diseño estadístico
Se utilizó un Diseño Completamente al Azar (DCA), con cuatro (4) tratamientos, incluido el testigo (tabla 01), con cinco (5) repeticiones por tratamiento y cinco (5) submuestras o unidades experimentales por repetición. La unidad experimental correspondió a una garrapata teleogina. Las variables respuestas evaluadas fueron mortalidad de garrapatas teleoginas e índices reproductivos en las garrapatas teleoginas (inhibición de ovoposición y peso de huevos). Para la evaluación de los análisis estadísticos y gráfico de datos, se aplicó la prueba de Dunnet mediante el software R.
Tabla 1. Distribución de los tratamientos utilizados
|
Tratamientos |
Descripción |
|
T0 |
Testigo (agua destilada estéril) |
|
T1 |
107 conídias /ml |
|
T2 |
108 conídias /ml |
|
T3 |
109 conídias /ml |
3. RESULTADOS Y DISCUSIÓN
La mortalidad de las garrapatas adulta se realizó en grupo de teleoginas mayor a 4.00 mm.
La evaluación por efecto del hongo Beauveria peruviensis se realizó diariamente hasta el día 6 posinoculación, en el cual se tuvo la mortalidad de todas las garrapatas en los 3 (tres) tratamientos y en el tratamiento testigo. Se evaluó mortalidad, inhibición de la ovoposición y el peso de los huevos ovopositados por las garrapatas de los tres tratamientos y del tratamiento testigo.
3.1.1. Mortalidad de teleoginas
En la diferenciación entre la mortalidad de las garrapatas por efecto de Beauveria peruviensis, o por causas naturales (ovoposición) u otra causa, se consideró el crecimiento del hongo (crecimiento de hifas) que fueron observadas a simple vista y con ayuda del estereoscopio. Las garrapatas por Beauveria se vuelven turgentes (o hinchadas). La penetración cuticular del hongo causa agujeros en el cuerpo de las garrapatas y expulsa la sangre con la que se alimentó antes de ser capturada.
El porcentaje de mortalidad en cada uno de los tratamientos se calculó mediante la fórmula según SENASA (2014).
%Mortalidad = (Pi – Pf)/(Pi ) x100
Donde: Pi = Población inicial; Pf = Población final.
La Eficacia de Beauveria peruviensis sobre Rhipicephalus microplus teleoginas y garrapatas no teleoginas se utilizó la fórmula de Schneider- Orelli (Campos y Velásquez, 2016).
%Eficacia (A – B)/(100-B) x100
Donde: A = Mortalidad en el tratamiento; B = Mortalidad en el testigo absoluto.
En la figura 4, se presenta los resultados de mortalidad y en la figura 5 la eficacia del hongo Beauveria peruviensis sobre Rhipicephalus microplus, donde se puede observar que todos los tratamientos lograron una mortalidad mayor al 50%, si se considera que los tratamientos 107, 108, 109 (conídias /ml) ocasionaron la mortalidad del 64 %, 80 % y 92 % de las garrapatas y, al mismo tiempo, afectaron la ovoposición de las misma. Se realizaron diversas investigaciones con el uso hongos entomopatógenos para el control de garrapatas, como la realizada por Nunes (2019), con Metarhizium anisopliae y Beauveria bassiana a diluciones de 1x107; 1x108y 1x109 conidias/ml quien encontró que M. anisopliae y B bassiana afectaron significativamente en 84 y 77,33%, respectivamente, la mortalidad de las teologinas de R. microplus, sin embargo, en un periodo de 14 días.
Así mismo, Nunes (2019), encontró que Metarhizium anisopliae, a la concentración de 109 conidias/mL, produjo un 89,02 % de mortalidad que fue menor a la mortalidad del 92 % producida por Beuaveria peruviensis y con una eficacia del 90.9% lo cual es superior al porcentaje reportado en dicho estudio. Oporta Lopez (2017) utilizó una dosis 1x107 conidios/ml del hongo Beauveria bassiana y consiguió una mortalidad del 84 % a los 20 días, que fue mayor al 64 % de mortalidad ocasionado por Beauveria Peruviensis a una misma concentración, sin embargo, el periodo de patogenicidad del hongo BP es mucho más rápido concentrándose la mortalidad en los días 4 y 5. La acción del hongo Beauveria peruviensis se debería a los mecanismos que tienen los hongos entomopatógenos, como su alta capacidad de acción, alta virulencia, capacidad de adhesión, germinación y penetración de la cutícula y del tracto digestivo del huésped a través de mecanismos físicos y de su habilidad de infectar de una garrapata a otra, y de su capacidad de desarrollarse en la hemolinfa (Álvarez el al. 2017).
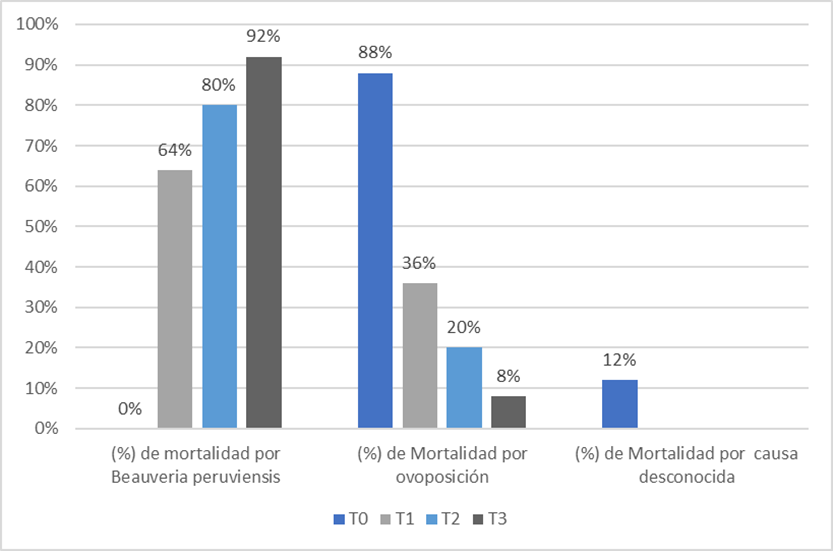
Figura 2. Porcentaje de cada causa de muertes de Rhipicephalus microplus teleoginas utilzadas.
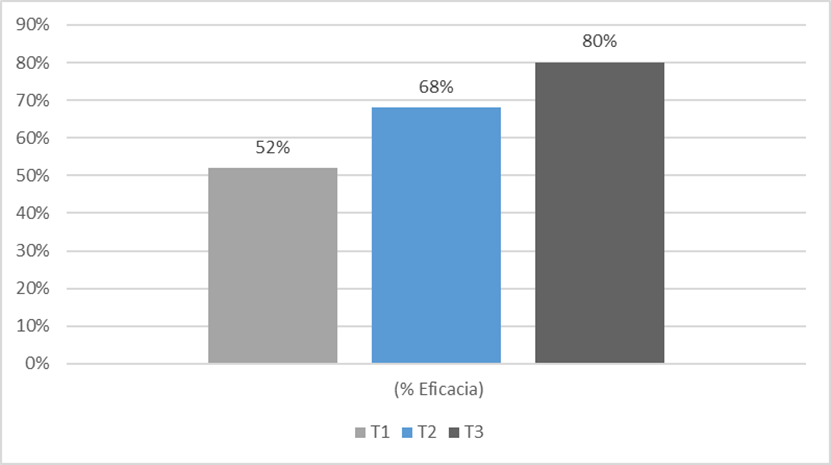
Figura 3. Porcentaje de eficacia de los tratamientos en la mortalidad de Rhipicephalus microplus teleoginas.
Tabla 2. Tabla de análisis de varianza de resumen sobre mortalidad de Rhipicephalus microplus teleoginas
|
|
|
Df |
Sum Sq |
Men Sq |
F Value |
Pr(>F) |
|
|
Tratamiento |
3 |
44.95 |
14.983 |
13.32 |
0.000129(***) |
|
|
Residuos |
16 |
18.00 |
1.125 |
|
|
*: Significativo. **: Altamente significativo. NS: No significativa.
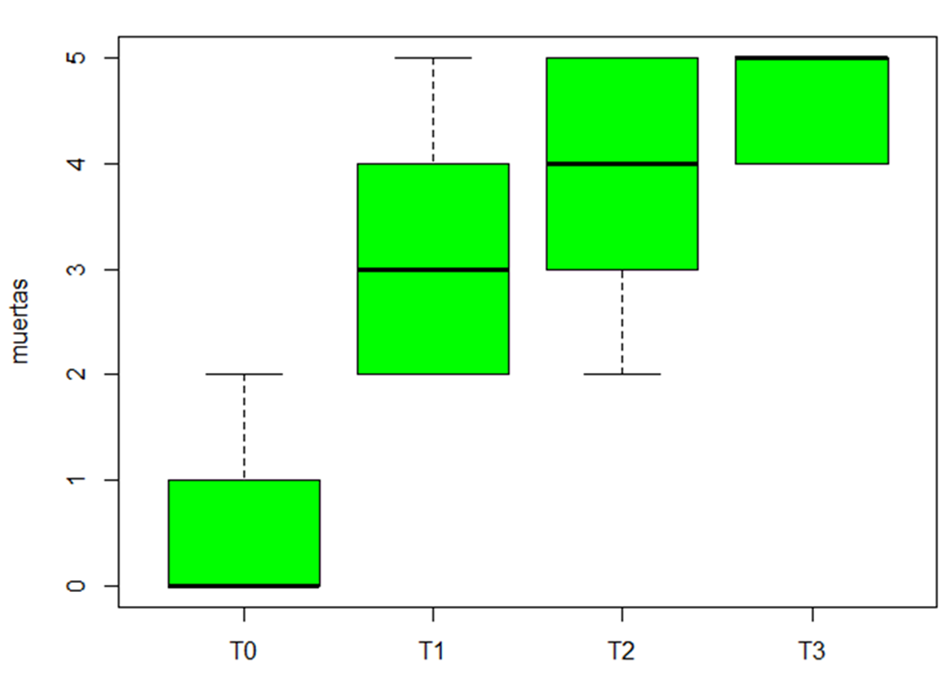
Figura 4. Numero de garrapatas Rhipicephalus microplus muertas por tratamiento.
Tabla 3. Prueba de Dunnett en mortalidad de garrapatas Rhipicephalus microplus teleoginas
|
Col Mean- Row Mean |
T0 |
T1 |
T2 |
|
T1 |
-1.969211 0.0245* |
|
|
|
T2 |
-2.570915 0.0051* |
-0.601703 0.2737 |
|
|
T3 |
-3.336720 0.0004* |
-1.367508 0.0857 |
-0.765804 0.2219 |
Al evaluar la Prueba Dunnett, se observó que el tratamiento testigo (T0) tuvo una diferencia altamente significativa con los tratamientos T1, T2, T3., al igual que todos los tratamientos. Por lo tanto, se concluye que todos los tratamientos son significativamente diferentes.
3.1.2. Efecto del hongo Beauveria peruviensis sobre la inhibición de la ovoposición
La inhibición de la ovoposición fue otro de los parámetros estudiados. Las distintas concentraciones de Beauveria peruviensis utilizadas en esta investigación disminuyen hasta un 60 % la ovoposición. Por otro lado, el peso de huevos por ovoposición por teleogina en el tratamiento 1x109 conidios/ml se manifestó una diferencia del 91 % con el testigo.
Estos resultados son relevantes al considerar que, en su ciclo de vida, la garrapata pone miles de huevos en el pasto y que eclosionan eventualmente a larva. Por lo tanto, al inhibirse la ovoposición y cantidad de huevos por ovoposición, se realiza un control directo sobre la población de garrapatas futuras (Álvarez et al.,2017). Gindini et al. (2002) y Fernández et al. (2010) evidenciaron que los hongos entomopatógenos como M. anisopliae reduce la fecundidad de las hembras y en conjunto con Beauveria sp. Además, fue utilizado para el control de varias especies de garrapatas. No obstante, al tratarse de un método de control biológico y no químico, los resultados encontrados por Beauveria peruviensis, para controlar el potencial reproductivo en un 90 %, resultan aceptables, porque para suprimir la ovoposición a un 99.9 %, se requiere una concentración del hongo Beauveria peruviensis sumamente más elevada. Al evaluar el efecto del hongo Beauveria peruviensis sobre la inhibición de la ovoposición, se obtuvo que la concentración 109 conídias /ml reduzca la ovoposición de las teleoginas (tabla 4) a un 60 % y se consiguió reducir el peso de los huevos ovopositados (g) (tabla 7), en comparación al peso de los huevos de las garrapatas del grupo testigo.
Tabla 4. Efecto del hongo Beauveria peruviensis sobre la inhibición de la ovoposición en Rhipicephalus microplus teleoginas
|
Tratamiento |
Unidades experimentales |
garrapatas que no ovoposicionaron por tratamiento |
|
T0 |
25 |
12% |
|
T1 (107) |
25 |
16% |
|
T2 (108 ) |
25 |
32% |
|
T3 (109 ) |
25 |
60% |
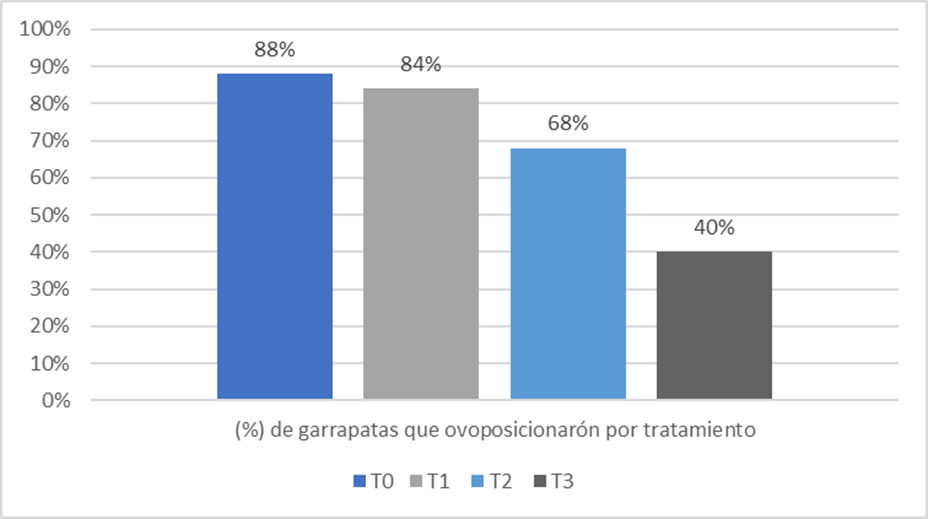
Figura 5. Porcentaje de garrapatas que ovoposicionaron de los tratamientos con Beauveria peruviensis y testigo.
Tabla 5. Tabla de análisis de varianza de resumen sobre ovoposición de Rhipicephalus microplus teleoginas
|
|
Df |
Sum Sq |
Mean Sq |
F value |
Pr(>F) |
|
Tratamiento |
3 |
19.35 |
6.45 |
4.373 |
0.0198 |
|
Residuos |
16 |
23.60 |
1.475 |
|
|
*: Significativo **: Altamente significativo NS: No significativa.
El análisis de varianza de los resultados (ANVA) muestra que los tratamientos tienen una diferencia altamente significativa, con respecto al testigo. Se trabajó con un α de 0.05 y se obtuvo un valor de p = 0.0198. Por lo tanto, se rechaza la H0, que indica que todos los tratamientos son iguales al testigo. El coeficiente de variación fue de CV=34.21.
De los efectos patogénicos de la disminución de la ovoposición de las garrapatas, ocasionados por los tratamientos en base al hongo Beauveria peruviensis (107, 108 y 10 9), de acuerdo a la Prueba Dunnett, solamente el tratamiento 3 (T 109) fue significativamente diferente a los resultados del tratamiento Testigo (T0). Los resultados de los T1 y T2 (107, 108) fueron similares a los resultados del grupo testigo. Los resultados del T1 son similares a los del T2 pero significativamente diferente con el T3.
Tabla 6. Prueba de Dunett en ovoposición de Rhipicephalus microplus teleoginas.
|
Col Mean- Row Mean |
T0 |
T1 |
T2 |
|
T1 |
0.000000 0.5000 |
|
|
|
T2 |
1.214941 0.1122 |
1.214941 0.1122 |
|
|
T3 |
2.429883 0.0076* |
2.429883 0.0076* |
1.214941 0.1122 |
3.1.3. Efecto del hongo Beauveria peruviensis sobre peso de huevos (g)
Al evaluar las fuentes de variabilidad ANVA, los tratamientos muestran una diferencia altamente significativos con referencia al testigo. Se trabajó con un α de 0.05 y se obtuvo un valor de p = 3.89e-06. Por lo tanto, se rechaza la H0 que indica que todos los tratamientos son iguales al testigo.
Tabla 7. Peso de huevos (g) por ovoposición y diferencias de peso (g) de huevos (Testigo vs Tratamientos) de Rhipicephalus microplus teleoginas sometidas al efecto de hongo Beauveria peruviensis.
|
Tratamiento |
Peso (g) promedio de huevos por ovoposición |
Diferencias de peso de huevos (testigo vs tto.) |
|
T0 |
0.0653 |
|
|
T1 |
0.0263 |
-0.0390 |
|
T2 |
0.0062 |
-0.0591 |
|
T3 |
0.0066 |
-0.0587 |
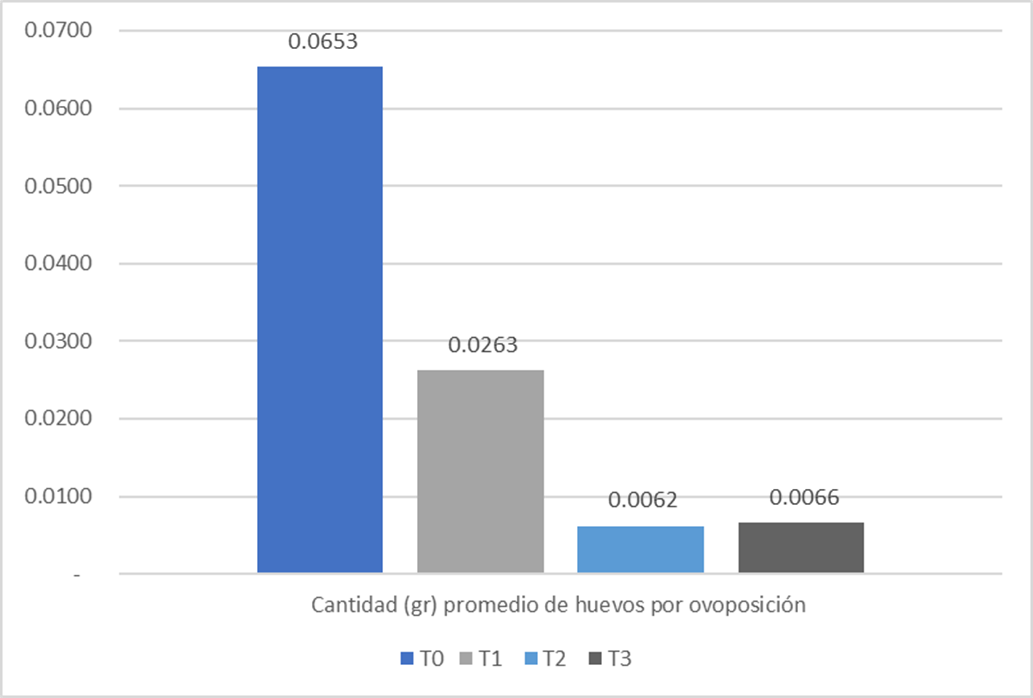
Figura 6. Peso promedio (gramos) de huevos por ovoposición de Rhipicephalus microplus teleoginas.
Tabla 8. Tabla de análisis de varianza de resumen sobre peso de huevos de Rhipicephalus microplus teleoginas.
|
|
|
Df |
Sum Sq |
Mean Sq |
F value |
Pr(>F) |
|
|
Tratamiento |
3 |
0.011571 |
0.003857 |
23.77 |
3.89e-06(***) |
|
|
Residuos |
16 |
0.002596 |
0.000162 |
|
|
*: Significativo **: Altamente significativo NS: No significativa.
Tabla 9. Prueba de Dunnett en peso de huevos de Rhipicephalus microplus teleoginas
|
Col Mean- Row Mean |
T0 |
T1 |
T2 |
|
T1 |
1.336306 0.0907 |
|
|
|
T2 |
3.314039 0.0005* |
1.214941 0.0240* |
|
|
T3 |
3.153682 0.0008* |
2.429883 0.0346 |
1.214941 0.4363 |
Al evaluar la Prueba Dunnett, se observó que el tratamiento testigo (T0) tuvo una diferencia significativa con los tratamientos T2 y T3, mientras que con el T1 actuaron de forma similar. El T1 fue diferente significativamente con el T2 pero actuó de modo similar al T3, El tratamiento T2 actuó similar al T3.

Figura 7. Colonización de Beauveria peruviensis en Rhipicephalus microplus.
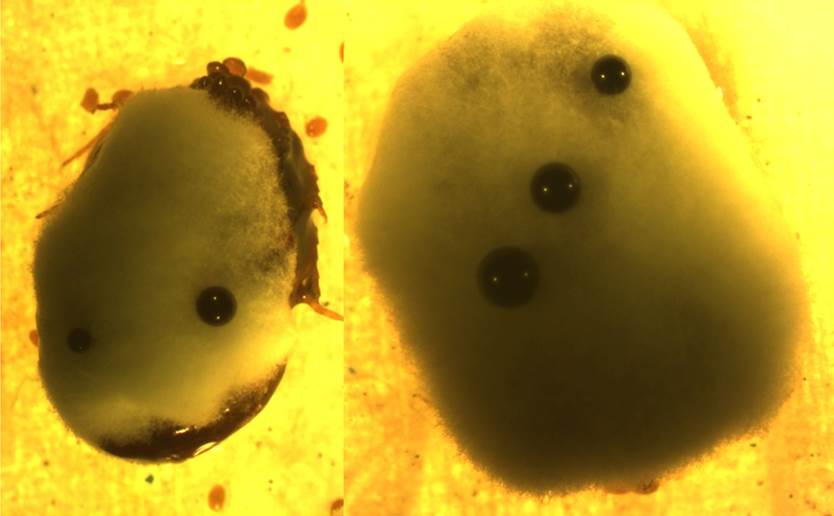
Figura 8. Laceraciones ocasionadas por Beauveria peruviensis en Rhipicephalus microplus.
4. CONCLUSIONES
En condiciones de laboratorio, el hongo Beauveria peruviensis fue altamente patogénico sobre Rhipicephalus microplus en estadio de teleoginas y alcanzó una mortalidad del 92% en la concentración de 109 conidios/ml. Así mismo, afecta considerablemente los parámetros reproductivos de las garrapatas adultas puestas a tratamiento. La prueba de Dunnet indica que todos los tratamientos muestran una diferencia significativa con el testigo. En definitiva, el hongo Beauveria peruviensis es patógeno para el género Rhipicephalus microplus en la etapa de teleogina.
Declaración de intereses
Ninguna.
Agradecimientos
Los autores agradecen a INDES-CES por financiar esta investigación.
Referencias
Álvarez, V., Matamoros-Carvajal, T. & Mena-Marín, A.L. (2017). Determinación, in vitro, de la eficacia de los hongos entomopatógenos, Beauveria bassiana y Metarhizium anisopliae, en el control de la garrapata común del ganado Rhipicephalus (Boophilus) microplus (Acari: Ixodidae). Ciencias Veterinarias, 35(1), 43-57.
Angelo, I.C., Fernandes, É.K., Bahiense, T.C., Perinotto, W.M., Moraes, A.P.R., Terra, A.L. & Bittencourt, V.R.E.P. (2010). Efficiency of Lecanicillium lecanii to control the tick Rhipicephalus microplus. Veterinary parasitology, 172(3-4), 317-322.
Arguedas, M., Alvares, V. & Bonilla, R. (2008). Eficacia del hongo entomopatógeno Metharrizium anisopliae en el control de Boophilus microplus (Acari: Ixodidae). Revista de Ciencias Agricolas, 32(2), 137–147. Recuperado de https://dialnet.unirioja.es/servlet/articulo?codigo=2930972
Broglio-Micheletti, S.M., de Souza, L.A., Valente, E.C., de Araújo, M.J., da Silva Dias, N. & Gómez-Torres, M.L. (2012). Evaluación de hongos entomopatógenos como agentes de control biológico para Rhipicephalus (Boophilus) microplus (Canestrini, 1887) (Acari: Ixodidae). Idesia (Arica), 30(1), 93-99.
Bustamante, D.E., Oliva, M., Leiva, S., Mendoza, J.E., Bobadilla, L., Angulo, G. & Calderon, M. (2019). Phylogeny and species delimitations in the entomopathogenic genus Beauveria (Hypocreales, Ascomycota), including the description of B. peruviensis sp. Nov. Mycokeys. Recuperado de https://mycokeys.pensoft.net/article/35764.
Campos, J.C. & Velásquez, H.A. (2016). Actividad biológica de dos cepas de Metarhizium anisopliae (Deuteromycota: Hyphomycetes) sobre Rhynchophorus palmarum L. (Coleóptera: Curculionidae) en condiciones de laboratorio. Tesis de grado, Bongara, Amazonas.
Cañedo V. & Ames T. (2004). Manual de laboratorio para el manejo de hongos entomopatógenos. International Potato Center.
Delgadillo, O.M., Gómez, M.A. & Jiménez, C.A. (2003). Evaluación del hongo entomopatógeno Beauveria Bassiana para la regulación de las poblaciones de garrapatas (Boophilus microplus) del ganado bovino en la Hacienda La Esperanza Municipio Mina El Limón del Departamento de León en el periodo de abril del 2006 a agosto del 2007. Recuperado de http://riul.unanleon.edu.ni:8080/jspui/bitstream/123456789/979/1/205100.pdf
Echeverry, D.N.P. & Osorio, L.A.R. (2016). Aspectos biológicos y ecológicos de las garrapatas duras. Ciencia & Tecnología Agropecuaria, 17(1), 81-95.
Fernández, M., Berlanga, A.M., Cruz, C. & Hernández, V.M. (2010). Evaluación de cepas de Beauveria bassiana y Metarhizium anisopliae sobre la inhibición de oviposición, eclosión y potencial reproductivo en una cepa triple resistente de garrapata Rhipicephalus (Boophilus) microplus (Canestrini) (Acari: Ixodidae). Entomotropica 25:109–115.
Fernández, J.A. (2006). Evaluación de la eficiencia del control de garrapatas (Boophilus microplus) con tres frecuencias de aplicación de BAZAM® (Beauveria bassiana). Recuperado de https://bdigital.zamorano.edu/bitstream/11036/803/1/T2239.pdf
Gindin, G., Samish, M., Zangi, G., Mishoutchenko, A. & Glazer, I. (2002). The susceptibility of different species and stages of ticks to entomopathogenic fungi. Experimental & applied acarology, 28(1), 283-288.
Guédez, C., Castillo, C., Cañizales, L. & Olivar, R. (2008). Control biológico: una herramienta para el desarrollo sustentable y sostenible. Academia, 7(13), 50-74.
López, E., López, G. & Orduz, S. (2009). Control de la garrapata Boophilus microplus con Metarhizium anisopliae, estudios de laboratorio y campo. Revista Colombiana de Entomología, 35(1), 42–46.
Nunes, P.R. (2019). Evaluación in vitro de hongos entomopatógenos en el control de la garrapata del ganado bovino. Saber, 31, 283-293.
Oliva, S.M. (2019). Filogenia molecular y delimitación de especies en el hongo entomopatógeno Beauveria (Hypocreales, Ascomycota).
Oporta, J.J. (2017). Control microbiano de la garrapata Rhipicephalus (Boophilus) microplus (Acari: Ixodidae) del ganado bovino, con hongos entomopatógenos en condiciones de laboratorio. Tesis doctoral, Universidad Nacional Agraria.
Pucheta, M., Flores, A., Rodríguez, S. & De la Torre, M. (2006). Mecanismo de acción de los hongos entomopatógenos. Interciencia, 31(12), 856-860.
Requejo, E. (2019). Patogenicidad de hongos entomopatógenos sobre picudo de la caña (Coleoptera: Curculionidae), bajo condiciones de laboratorio, Chachapoyas-Amazonas. Doctoral dissertation, Universidad Nacional Toribio Rodríguez de Mendoza-UNTRM.
Salazar, R.S. (2015). Variación de la población de garrapatas Rhipicephalus microplus sobre bovinos pastoreando en sistemas silvopastoriles y monocultivos tradicionales. Recuperado de https://repositorio.unal.edu.co/bitstream/handle/unal/58063/32183129.2015.pdf?sequence=1&isAllowed=y
SENASA. (2014). Manual de producción y uso de hongos entomopatógenos. Lima -Perú: Laboratorio de Entomopatógenos SCB - SENASA.
Tofiño, A.P., Ortega, M., Pedraza, B., Perdomo, S.C. & Moya, D.C. (2018). Efectividad de Beauveria bassiana (Baubassil®) sobre la garrapata común del ganado bovino Rhipicephalus microplus en el Departamento de la Guajira, Colombia. Revista argentina de microbiología, 50(4), 426–430. Recuperado de https://www.sciencedirect.com/science/article/pii/S0325754117301773
Walker, J.B. (1977). Técnicas de investigación para las especies de garrapata que afectan a los animales domésticos. Documento presentado en el Seminario internacional sobre ecología y control de los parásitos externos de importancia económica que afectan el ganado en América Latina. Centro Internacional de Agricultura Tropical (Ciat) p. 27-40.
Zárate, H. (2016). Adaptación de Metarhizium sp como entomopatógeno de garrapatas. México.
