

Cultivo dual in vitro de cepas nativas de Trichoderma spp. frente a Botrytis sp. patógeno de Passiflora ligularis Juss
Dual in vitro culture of native strains of Trichoderma spp. against Botrytis sp. pathogen of Passiflora ligularis Juss
Luis T. Acosta1,a,*, Deysi K. Azania1,b, Rolando Azania1,c
1 Universidad Nacional Daniel Alcides Carrión, Oxapampa, Perú.
a Ing.,
![]() luistibhy@hotmail.com,
luistibhy@hotmail.com, ![]() https://orcid.org/0000-0002-1276-1777
https://orcid.org/0000-0002-1276-1777
b Ing.,
![]() deysikaf@hotmail.com,
deysikaf@hotmail.com, ![]() https://orcid.org/0000-0003-1441-7897
https://orcid.org/0000-0003-1441-7897
c
Ing.,
![]() rolandfox18@gmail.com,
rolandfox18@gmail.com, ![]() https://orcid.org/0000-0002-5130-4923
https://orcid.org/0000-0002-5130-4923
* Autor de Correspondencia: Tel. +51 941696300
http://dx.doi.org/10.25127/riagrop.20214.720
Resumen
El objetivo de la investigación fue evaluar el nivel de antagonismo de trece cepas nativas de Trichoderma spp. frente a Botrytis sp. A nivel in vitro, se evaluó mediante el método de cultivo dual en placas Petri con Papa Dextrosa Agar (PDA), donde se observó crecimiento radial, competencia por espacio y nutrientes, micoparasitismo y grado de inhibición; se utilizó el diseño completamente aleatorio, con 27 tratamientos y 4 repeticiones. Los resultados del enfrentamiento de las cepas de Trichoderma spp. frente a Botrytis sp. mostraron un superior crecimiento radial para Trichoderma. Por otro lado, todos los tratamientos de Trichoderma spp. lograron restringir el desarrollo de Botrytis sp., con respecto a su testigo. En la competencia por espacio y nutrientes, las cepas nativas evaluadas de Trichoderma pueden ser un recurso valioso para su evaluación en el control biológico de otras enfermedades en el cultivo de granadilla, como también en el establecimiento de dosis efectivas de las cepas de Trichoderma spp. para el control preventivo de plántulas de granadilla a nivel de invernadero y campo.
Palabras claves: granadilla, control biológico, enfermedades, dosis.
Abstract
The objective of the research was evaluate the level of antagonism of thirteen native strains of Trichoderma spp. against Botrytis sp. At the in vitro level, it was evaluated by the method dual culture in Petri dishes with Potato Dextrose Agar (PDA), where growth was observed radial, space competition and nutrients, mycoparasitism and degree inhibition; the design was used completely random, with 27 treatments and 4 repetitions. The results of the confrontation of the strains of Trichoderma spp. versus Botrytis sp. showed a superior radial growth for Trichoderma. On the other hand, all Trichoderma spp. treatments managed to restrict the development of Botrytis sp. regarding your witness; in the competition for space and nutrients. The native strains evaluated from Trichoderma can be a valuable resource for evaluation in the biological control of other diseases in the cultivation of sweet granadilla, as well as in the establishment of effective doses of the strains of Trichoderma spp. for the preventive control of sweet granadilla seedlings at the greenhouse and field level.
Keywords: sweet granadilla, biological control, diseases, dose.
1. INTRODUCCIÓN
En el antagonismo, se conoce un grupo importante de hongos y bacterias que presentan efecto antagónico sobre otros microorganismos. Este efecto es aprovechado por el hombre para la regulación, tanto de patógenos cuyo hábitat es el suelo, como aquellos que se desarrollan en la parte foliar de las plantas (Infante et al. 2009). Los antagonistas contribuyen a la atenuación de los daños que causan las enfermedades en los agroecosistemas donde existan condiciones para su desarrollo y conservación. Entre las especies más ampliamente estudiadas y aplicadas al control biológico, se encuentran las del género Trichoderma, debido a su eficaz control, capacidad reproductiva, plasticidad ecológica y efecto estimulante sobre los cultivos (Infante et al. 2009).
La producción de granadilla (Passiflora ligularis Juss.) en Oxapampa es afectada por enfermedades, sobre todo, en los meses de mayor precipitación, causada por Botrytis sp., Fusarium spp. y Colletotrichum spp. entre otros. El control de estos hongos patógenos, actualmente, se realiza con plaguicidas que son aplicados al follaje, a las semillas y al suelo. Su uso origina problemas tales como la destrucción de la capa de ozono; contaminación del ambiente, al acumularse en el agua, suelo, plantas y animales; peligro para la salud de los agricultores cuando el uso es sin ningún tipo de protección y precaución; enfermedades en humanos y animales cuando se consumen productos vegetales contaminados con residuos tóxicos que pueden producir la muerte; exterminio de microorganismos benéficos, muchas veces alteran el equilibrio ecológico; resistencia por parte de los patógenos y conversión en plaga de aquellos organismos no considerados como tales.
La búsqueda de alternativas al uso de los plaguicidas direcciona la mirada de los investigadores hacia los microorganismos, para su utilización como agentes de control biológico, en el control de patógenos de plantas. Esto es por la diversidad de microorganismos nativos factibles de utilizarse, tanto hongos como bacterias, reconocidos como supresores de patógenos de plantas, limitando la severidad de las enfermedades en los cultivos (Memenza, 2009).
Trichoderma spp. es de distribución cosmopolita. Se presenta principalmente en zonas que contienen materia orgánica o desechos vegetales en descomposición. Los mecanismos de acción que presentan distintas especies del género Trichoderma se apoyan principalmente en la fuerte capacidad competitiva por espacio y nutrientes, también se han reportado como parásitos de gran número de organismos fungosos fitopatógenos (Esparza, 2009). En el estudio de investigación aislamiento, identificación y caracterización cultural de cepas nativas de Trichoderma spp. en la provincia de Oxapampa, se caracterizó culturalmente en medio de cultivo PDA 15 cepas nativas de Trichoderma y se describió las características macroscópicas y microscópicas más importantes, siendo las especies T. viride y T. harzianum las más abundantes de esta colección (Rosales 2012). Por tanto, es necesario la prueba in vitro de trece cepas nativas de Trichoderma spp. frente a Botrytis sp., considerado como uno de los principales patógenos de P. ligularis Juss. El objetivo de este trabajo fue evaluar el nivel de antagonismo de trece cepas nativas de Trichoderma spp. frente a Botrytis sp., resultados que permitirá a los investigadores disponer de información importante para la selección y uso de este controlador biológico.
2. MATERIALES Y MÉTODOS
2.1. Lugar de estudio
El experimento fue realizado en el Laboratorio de Fitopatología de la Universidad Nacional Daniel Alcides Carrión, sede Oxapampa, ubicada en el distrito y provincia de Oxapampa, región de Pasco; las condiciones del ambiente dentro del laboratorio fueron en promedio una temperatura de 19 ºC y humedad relativa de 67% durante la experimentación.
2.2. Material biológico
Aislamientos del hongo: Botrytis sp. patógeno de P. ligularis Juss. (granadilla) y las cepas nativas de Trichoderma spp. del cepario del Laboratorio de Fitopatología de la Universidad Nacional Daniel Alcides Carrión, sede Oxapampa.
2.3. Medio de cultivo
El medio de cultivo utilizado para el desarrollo y enfrentamiento in vitro de Botrytis sp. y cepas de Trichoderma spp. fue papa dextrosa agar (PDA).
2.4. Metodología
2.4.1. Purificación de cepas nativas de Trichoderma spp. a partir de cepario
Del cepario de conservación, se purificaron cada cepa de Trichoderma spp., de la siguiente manera: de un tubo de ensayo con Trichoderma spp., se extrajo una porción de micelio con un estilete (desinfectado por flameado) para trasladarlo a una placa Petri con medio de cultivo (PDA más cloranfenicol al 0.05 %); seguido se dejó incubar de tres a cinco días hasta observar crecimiento de micelio blanquecino; luego, de este micelio se extrajo las primeras hifas y se realizó un subcultivo que se dejó desarrollar hasta la esporulación (se observó micelio de color verduzco, característico de Trichoderma), este se utilizó como inóculo para el cultivo monoespórico y posterior conservación en el cepario.
2.4.2. Recolección de muestras del patógeno (Botrytis sp.)
La colecta de frutos de granadilla (P. ligularis) con signos de Botrytis sp. se realizó en el sector de Navarra, entre las quebradas Tres Marías y Negro del distrito de Huancabamba, provincia de Oxapampa.
2.4.3. Aislamiento del patógeno
Botrytis sp.- El
material muestra (fruto de granadilla) se aisló a partir del signo típico de
Botrytis, que corresponde a una esporulación grisácea, previa observación de
conidios con un estereoscopio. Seguido, se realizaron cortes de tejido en la
zona de avance del patógeno de aproximadamente 17 mm de diámetro. Se desinfectó
el material (tejido vegetal infectado) mediante inmersiones secuenciales con
lejía Clorox (hipoclorito de sodio al 4% de concentración) diluida (1 ml por 1
Lt de agua) por 30 segundos y finalmente se lavó en agua destilada estéril por
5 minutos. Luego tejido vegetal infectado, se sembró en placas Petri con PDA y
se incubaron a 22 ![]() 1 °C por dos
días. A partir de las primeras hifas del hongo presentadas en el medio, se
realizaron subcultivos para evitar posible contaminación.
1 °C por dos
días. A partir de las primeras hifas del hongo presentadas en el medio, se
realizaron subcultivos para evitar posible contaminación.
2.4.4. Identificación del patógeno
Botrytis sp.- Se sembró discos de PDA con micelio de la cepa aislada en una placa Petri con medio de cultivo y se dejó desarrollar para luego observar al microscopio estructuras características de Botrytis sp., las que se verificaron con las claves de Barnett y Hunter (1998).
2.4.5. Estudio de variables
Crecimiento radial: se midió el avance del micelio del hongo a partir del segundo día después de la siembra, luego cada 24 h. Competencia por área y nutrientes: se obtuvo con los radios de crecimiento radial para Trichoderma, Botrytis y testigos. Micoparasitismo: la capacidad antagónica de las cepas de Trichoderma spp. se determinó por la escala propuesta por Bell et al. (1982), detallada en tabla 1. Además, se evaluó la interacción de las hifas por observación con microscopio binocular Helmut Hund GmbH con aumento de 100X. Grado de inhibición (GI): se estimó con la fórmula utilizada por Sarro et al. (2010): GI = [Ap – Ap+a]/Ap x 100, donde Ap es el crecimiento radial del patógeno testigo y Ap+a es el crecimiento radial del patógeno más el antagonista (cuando es enfrentado).
Tabla 1. Escala de estimación de micoparasitismo
|
Clases |
Valor (%) |
Descripción |
|
1 |
100 |
Trichoderma sobrecrece completamente al patógeno y cubre totalmente la superficie del medio. |
|
2 |
92.05 |
Trichoderma sobrecrece las dos terceras partes de la superficie del medio. |
|
3 |
50 |
Trichoderma y el patógeno crecen aproximadamente la mitad de la superficie y ninguno domina al otro. |
|
4 |
7.95 |
El patógeno coloniza las dos terceras partes de la superficie del medio y resiste la invasión por Trichoderma. |
|
5 |
0 |
El patógeno sobrecrece completamente a Trichoderma y ocupa la superficie total del medio. |
2.5. Análisis de datos
En el experimento se usó el diseño completamente aleatorizado con veintisiete tratamientos y cuatro repeticiones. La unidad experimental consto de cuatro placas Petri con medio PDA a pH 6.5.
Los
datos obtenidos de las diferentes variables se ordenaron en hojas de cálculo de
Microsoft Excel y se procesaron con el software estadístico InfoStat, versión
2013; aplicando el análisis de varianza para determinar la significancia entre
tratamientos y la prueba de significación de Duncan con ![]() = 0.05 para
establecer jerarquía e igualdad de los tratamientos.
= 0.05 para
establecer jerarquía e igualdad de los tratamientos.
3. RESULTADOS Y DISCUSIÓN
3.1. Caracterización cultural e identificación de Botrytis sp.
3.1.1. Caracterización cultural
La caracterización cultural de la cepa de código MANB01 (inóculo puro del hongo) en PDA, presento una tasa de crecimiento de micelio de 1.18 cm/día. Además, presento las siguientes características en placa con medio PDA: i) Aspecto de colonia: crecimiento normal, ni muy elevado ni muy sumergido, compacta, con una zona de esporulación al 4 día después de la siembra (dds) o incubación, las cuales se secan rápidamente; ii) Conidiación: compacta, blanca al 3 dds y tornándose marrón claro al 4 dds, dispuesta en un aro de conidiación de color marrón oscuro en forma de anillo de un grosor de 1 cm, las zonas libres de conidiación son cubiertas por abundante micelio aéreo, blanquecino; iii) Color del reverso de la placa: incoloro no hay cambio en el medio de cultivo y iv) Olor de la colonia: sin olor.
3.1.2. Identificación
Se identificó morfológicamente la cepa Botrytis sp. en base a su estructura fructificante, características macroscópicas y microscópicas (figura 1) en contraste a las claves de Barnett y Hunter (1998) utilizadas; esta cepa se codifico como MANB01. Continuadamente se describen las características microscópicas: i) Conidióforos: de color marrón, erguidos, septados y ramificados, ramas pequeñas unidas en su punto de origen; ii) Conidios: ovalados en forma de huevo, presenta comúnmente un punto de unión sobresaliente ligeramente, de color marrón pálido y de tamaño: largo (promedio 10.2 µm) y ancho promedio (6.12 µm) y iii) Esclerocios: presentes y poco abundantes, a los 15 dds.
Los caracteres microscópicos distintivos como: conidióforo, conidio, esclerocio y tipo de micelio concuerdan con las claves descritas por Barnett y Hunter (1998). Asimismo, hay cierta similitud con lo descrito por Pitt y Hocking (2009) quienes caracterizaron a B. cinérea en medios de cultivos CYA y MEA: el hongo mostro un micelio aéreo y/o aglomerado (flocoso), ritmo de crecimiento variado y el color del micelio fue de blanco a gris oscuro (producto de la conidiogénesis); también, observaron talos de duración indeterminada, presencia de conidióforos, conidios elipsoidales de 8 - 12 µm de largo de pared lisa.
3.2. Trichoderma spp. Frente a Botrytis sp.
El crecimiento radial de micelio de Trichoderma spp. por efecto del enfrentamiento contra Botrytis sp. y sus testigos demostraron que existen diferencias estadísticas significativas (p ˂ 0.05), con un coeficiente de variabilidad de 6.5%.
La
prueba de comparación múltiple de Duncan (![]() =0.05 de
probabilidad) jerarquizo las medias de los tratamientos estudiados (tabla 2)
para el crecimiento radial de micelio de las cepas de Trichoderma en
enfrentamiento y testigo. Resaltando estadísticamente a T. koningii
(MHSJ11) con 4.47 cm y enfrentado con Botrytis sp. obtuvo 4.38 cm; T.
inhamatum (MOBSHO01) con 4.42 cm y enfrentado con Botrytis sp. logró
4.26 cm; T. harzianum (MHMLL04) con 4.25 cm y T. atroviride
(MHSJ01) enfrentado con Botrytis sp. consiguió 4.12 cm respectivamente.
Posiblemente por una mayor velocidad de crecimiento y un rápido reconocimiento
del patógeno. Por el contrario, la cepa T. longibrachiatum (MJHU01) con
1.3 cm, y enfrentado con Botrytis sp., alcanzó 1.15 cm presentó un
crecimiento radial significativamente inferior; tal vez por su crecimiento
lento y nula diseminación en el medio que es una característica genética,
acciones que no bloquean el desarrollo del patógeno. Además, cepas testigos y
enfrentados de la misma especie no presentaron un crecimiento radial de micelio
estadísticamente igual, como es el caso de las cepas T. harzianum
(MHMLL04) con 4.25 cm y enfrentado con Botrytis sp. adquirió 4.09 cm,
seguido de T. atroviride (MHSJ01) - Botrytis sp. obtuvo 4.12 cm y
T. atroviride (MHSJ01) adquirió 4.06 cm la cepa T. citrinoviride
(MHMLL03) logró 3.91 cm y enfrentado con Botrytis sp. consiguió 3.46 cm,
precedido de la cepa T. atroviride (MHMLL06) con 3.79 cm y enfrentado
con Botrytis sp. obtuvo 3.49 cm y finalmente por la cepa T. inhamatum
(MOBSHO03) con 3.52 cm y enfrentado con Botrytis sp. alcanzó 3.02 cm.
Los resultados anteriores probablemente se deban a que hay cepas de una misma
especie con características genéticas diferentes. En efecto, Trichoderma
presenta actividad inhibitoria sobre diversos fitopatógenos (Dennis y Webster
1971). Asimismo, los resultados obtenidos en este estudio son similares a los
de Chambers y Scott (1995), quienes utilizaron la misma técnica y encontraron
que T. hamatum y T. pseudokoningii inhibieron el crecimiento
micelial de Phytophthora spp. a nivel in vitro.
=0.05 de
probabilidad) jerarquizo las medias de los tratamientos estudiados (tabla 2)
para el crecimiento radial de micelio de las cepas de Trichoderma en
enfrentamiento y testigo. Resaltando estadísticamente a T. koningii
(MHSJ11) con 4.47 cm y enfrentado con Botrytis sp. obtuvo 4.38 cm; T.
inhamatum (MOBSHO01) con 4.42 cm y enfrentado con Botrytis sp. logró
4.26 cm; T. harzianum (MHMLL04) con 4.25 cm y T. atroviride
(MHSJ01) enfrentado con Botrytis sp. consiguió 4.12 cm respectivamente.
Posiblemente por una mayor velocidad de crecimiento y un rápido reconocimiento
del patógeno. Por el contrario, la cepa T. longibrachiatum (MJHU01) con
1.3 cm, y enfrentado con Botrytis sp., alcanzó 1.15 cm presentó un
crecimiento radial significativamente inferior; tal vez por su crecimiento
lento y nula diseminación en el medio que es una característica genética,
acciones que no bloquean el desarrollo del patógeno. Además, cepas testigos y
enfrentados de la misma especie no presentaron un crecimiento radial de micelio
estadísticamente igual, como es el caso de las cepas T. harzianum
(MHMLL04) con 4.25 cm y enfrentado con Botrytis sp. adquirió 4.09 cm,
seguido de T. atroviride (MHSJ01) - Botrytis sp. obtuvo 4.12 cm y
T. atroviride (MHSJ01) adquirió 4.06 cm la cepa T. citrinoviride
(MHMLL03) logró 3.91 cm y enfrentado con Botrytis sp. consiguió 3.46 cm,
precedido de la cepa T. atroviride (MHMLL06) con 3.79 cm y enfrentado
con Botrytis sp. obtuvo 3.49 cm y finalmente por la cepa T. inhamatum
(MOBSHO03) con 3.52 cm y enfrentado con Botrytis sp. alcanzó 3.02 cm.
Los resultados anteriores probablemente se deban a que hay cepas de una misma
especie con características genéticas diferentes. En efecto, Trichoderma
presenta actividad inhibitoria sobre diversos fitopatógenos (Dennis y Webster
1971). Asimismo, los resultados obtenidos en este estudio son similares a los
de Chambers y Scott (1995), quienes utilizaron la misma técnica y encontraron
que T. hamatum y T. pseudokoningii inhibieron el crecimiento
micelial de Phytophthora spp. a nivel in vitro.
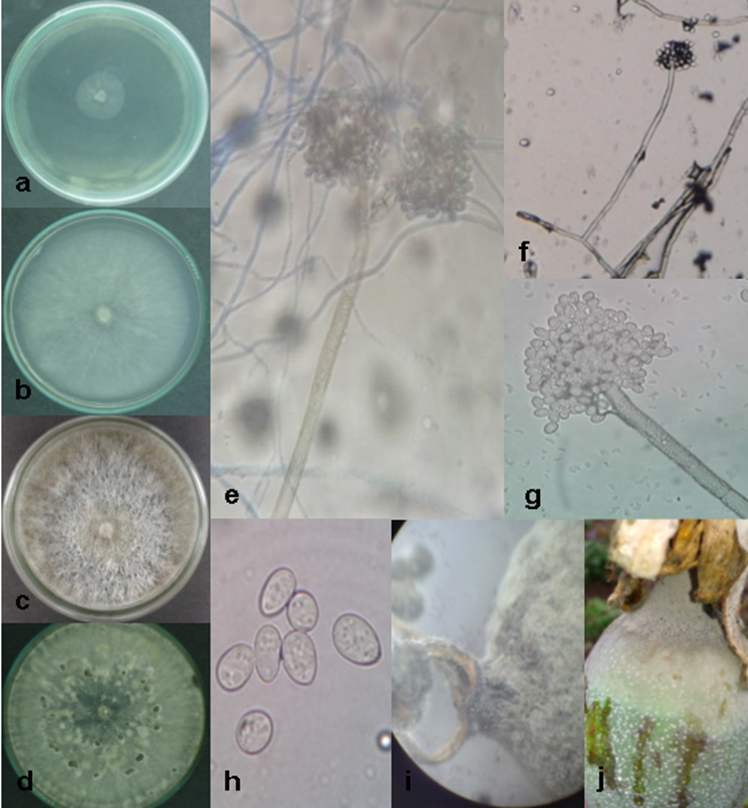
Figura 1. Características macroscópicas y microscópicas de Botrytis sp. (MANB01). Crecimiento del hongo en PDA: a. 1 dds, b. 3 dds, c. 8 dds, d. 15 dds (micelio con esclerocios), e. Conidióforo con conidios 40X, f. Conidióforo y conidios 10X, g. Conidióforo y conidios 40X, h. Conidios ovalados 100X, i. Conidiación (visto a estereoscopio 10X), j. Muestra: fruto de granadilla (P. Ligularis) con signos de Botrytis sp.
Tabla 2. Comparacion de medias para el crecimiento radial de micelio de Trichoderma spp. por efecto del enfrentamiento con Botrytis sp. y testigos
|
Trichoderma spp. vs Botrytis sp. y testigos |
Crecimiento radial de micelio (cm) 3 dds. |
Prueba de Duncan (α=0.05) |
|
T. koningii (MHSJ11) |
4.47 |
a |
|
T. inhamatum (MOBSHO01) |
4.42 |
ab |
|
T. koningii (MHSJ11) vs Botrytis sp. |
4.38 |
ab |
|
T. inhamatum (MOBSHO01) vs Botrytis sp. |
4.26 |
abc |
|
T. harzianum (MHMLL04) |
4.25 |
abc |
|
T. atroviride (MHSJ01) vs Botrytis sp. |
4.12 |
abcd |
|
T. harzianum (MHMLL04) vs Botrytis sp. |
4.09 |
bcd |
|
T. atroviride (MHSJ01) |
4.06 |
bcde |
|
T. koningii (MCHT11) vs Botrytis sp. |
4.05 |
bcde |
|
T. koningii (MCHT11) |
3.98 |
cdef |
|
T. citrinoviride (MHMLL03) |
3.91 |
cdefg |
|
T. atroviride (MHMLL06) |
3.79 |
defgh |
|
T. harzianum (MCHT07) |
3.71 |
efgh |
|
T. harzianum (MOSA05) |
3.63 |
fgh |
|
T. harzianum (MCHT07) vs Botrytis sp. |
3.62 |
fgh |
|
Botrytis sp. |
3.55 |
ghi |
|
T. atroviride (MOBSHO03) |
3.52 |
hi |
|
T. harzianum (MOSA05) vs Botrytis sp. |
3.51 |
hi |
|
T. atroviride (MHMLL06) vs Botrytis sp. |
3.49 |
hi |
|
T. citrinoviride (MHMLL03) vs Botrytis sp. |
3.46 |
hij |
|
T. strictipile (MCHT04) |
3.23 |
ijk |
|
T. strictipile (MCHPS03) |
3.23 |
ijk |
|
T. strictipile (MCHT04) vs Botrytis sp. |
3.11 |
jk |
|
T. strictipile (MCHPS03) vs Botrytis sp. |
3.03 |
k |
|
T. atroviride (MOBSHO03) vs Botrytis sp. |
3.02 |
k |
|
T. longibrachiatum (MJHU01) |
1.30 |
l |
|
T. longibrachiatum (MJHU01) vs Botrytis sp. |
1.15 |
l |
El análisis de varianza para el crecimiento radial de micelio de Botrytis sp., por efecto del enfrentamiento contra cepas de Trichoderma spp. y testigo, indico la existencia de diferencias estadísticas altamente significativas (p < 0.01), con un coeficiente de variabilidad de 2.7%.
La
comparación múltiple de medias de Duncan (![]() =0.05 de
probabilidad) presento un menor crecimiento radial de micelio (2.41 cm) para Botrytis
sp. producto del enfrentamiento a T. atroviride (MHSJ01); evidenciando
que la cepa T. atroviride (MHSJ01) es estadísticamente superior al resto
(tabla 3), por inhibir el crecimiento micelial del patógeno; estos resultados
posiblemente puedan deberse a la segregación de metabolitos secundarios y
antibióticos que limitan el desarrollo normal de Botrytis. Por el contrario, la
cepa T. harzianum (MCHT07) presento una menor inhibición en el
crecimiento mecelial del patógeno (3.96 cm). Además, cepas de Trichoderma
identificadas como una misma especie presentaron contingencia en el crecimiento
del micelio de Botrytis con respecto al testigo; pero no presentaron un
comportamiento similar, como se detalla: Botrytis sp. - T. atroviride
(MOBSHO03) obtuvo 3.17 cm y Botrytis sp. - T. atroviride
(MHMLL06) logró 3.39 cm. De igual manera, Botrytis sp. - T.
strictipile (MCHT04) alcanzó 3.22 cm y Botrytis sp. - T.
strictipile (MCHPS03) obtuvo 3.44 cm y también Botrytis sp. - T.
harzianum (MHMLL04) adquirió 3.39 cm y Botrytis sp. - T.
harzianum (MCHT07) agenció 3.69 cm. Los resultados anteriores probablemente
puedan deberse a las diferentes características genéticas de cada cepa, en el
rápido o lento desarrollo. Por otro lado, las cepas de Trichoerma enfrentadas
al patogeno: Botrytis sp. - T. koningii (MHSJ11) con 3.43 cm y Botrytis
sp. - T. koningii (MCHT11) con 3.46 cm fueron las que presentaron efecto
antagónico estadísticamente igual en el crecimiento radial de micelio de
Botrytis, posiblemente se deba a que presentan las mismas características de
reconocimiento y reacción frente al patógeno. El crecimiento radial de micelio
de Botrytis sp. fue variado con respecto a su testigo, producto de la
interacción antagónica con las cepas de Trichoderma spp.; asimismo, hay
variación en la efectividad de las diferentes cepas de Trichoderma. Asimismo,
Campbell (1989) ha observado que las cepas de Trichoderma spp. varían en
su efecto antagónico debido a la versatilidad de mecanismos que posee, y que
estos se expresan según las características genéticas prevalentes. Cabe agregar
que, el sobrecrecimiento del micelio de Trichoderma en el micelio de un
patógeno, es una característica ventajosa en la disputa de colonizar un área;
esta característica reduce o detiene completamente el desarrollo del micelio
del patógeno (Dennis y Webster 1971).
=0.05 de
probabilidad) presento un menor crecimiento radial de micelio (2.41 cm) para Botrytis
sp. producto del enfrentamiento a T. atroviride (MHSJ01); evidenciando
que la cepa T. atroviride (MHSJ01) es estadísticamente superior al resto
(tabla 3), por inhibir el crecimiento micelial del patógeno; estos resultados
posiblemente puedan deberse a la segregación de metabolitos secundarios y
antibióticos que limitan el desarrollo normal de Botrytis. Por el contrario, la
cepa T. harzianum (MCHT07) presento una menor inhibición en el
crecimiento mecelial del patógeno (3.96 cm). Además, cepas de Trichoderma
identificadas como una misma especie presentaron contingencia en el crecimiento
del micelio de Botrytis con respecto al testigo; pero no presentaron un
comportamiento similar, como se detalla: Botrytis sp. - T. atroviride
(MOBSHO03) obtuvo 3.17 cm y Botrytis sp. - T. atroviride
(MHMLL06) logró 3.39 cm. De igual manera, Botrytis sp. - T.
strictipile (MCHT04) alcanzó 3.22 cm y Botrytis sp. - T.
strictipile (MCHPS03) obtuvo 3.44 cm y también Botrytis sp. - T.
harzianum (MHMLL04) adquirió 3.39 cm y Botrytis sp. - T.
harzianum (MCHT07) agenció 3.69 cm. Los resultados anteriores probablemente
puedan deberse a las diferentes características genéticas de cada cepa, en el
rápido o lento desarrollo. Por otro lado, las cepas de Trichoerma enfrentadas
al patogeno: Botrytis sp. - T. koningii (MHSJ11) con 3.43 cm y Botrytis
sp. - T. koningii (MCHT11) con 3.46 cm fueron las que presentaron efecto
antagónico estadísticamente igual en el crecimiento radial de micelio de
Botrytis, posiblemente se deba a que presentan las mismas características de
reconocimiento y reacción frente al patógeno. El crecimiento radial de micelio
de Botrytis sp. fue variado con respecto a su testigo, producto de la
interacción antagónica con las cepas de Trichoderma spp.; asimismo, hay
variación en la efectividad de las diferentes cepas de Trichoderma. Asimismo,
Campbell (1989) ha observado que las cepas de Trichoderma spp. varían en
su efecto antagónico debido a la versatilidad de mecanismos que posee, y que
estos se expresan según las características genéticas prevalentes. Cabe agregar
que, el sobrecrecimiento del micelio de Trichoderma en el micelio de un
patógeno, es una característica ventajosa en la disputa de colonizar un área;
esta característica reduce o detiene completamente el desarrollo del micelio
del patógeno (Dennis y Webster 1971).
Tabla 3. Promedio de crecimiento radial de micelio de Botrytis sp. por efecto del enfrentamiento contra Trichoderma spp. y testigo
|
Botrytis sp. vs Trichoderma spp. |
Crecimiento radial de micelio (cm), 3 dds. |
Prueba de Duncan (α=0.05) |
|
Botrytis sp. vs T. atroviride (MHSJ01) |
2.41 |
a |
|
Botrytis sp. vs T. longibrachiatum (MJHU01) |
3.09 |
b |
|
Botrytis sp. vs T. atroviride (MOBSHO03) |
3.17 |
bc |
|
Botrytis sp. vs T. strictipile (MCHT04) |
3.22 |
c |
|
Botrytis sp. vs T. harzianum (MHMLL04) |
3.39 |
d |
|
Botrytis sp. vs T. atroviride (MHMLL06) |
3.39 |
d |
|
Botrytis sp. vs T. inhamatum (MOBSHO01) |
3.41 |
d |
|
Botrytis sp. vs T. koningii (MHSJ11) |
3.43 |
d |
|
Botrytis sp. vs T. strictipile (MCHPS03) |
3.44 |
d |
|
Botrytis sp. vs T. citrinoviride (MHMLL03) |
3.45 |
d |
|
Botrytis sp. vs T. koningii (MCHT11) |
3.46 |
d |
|
Botrytis sp. vs T. harzianum (MOSA05) |
3.49 |
d |
|
Botrytis sp. vs T. harzianum (MCHT07) |
3.69 |
e |
3.3. Competencia por espacio y nutrientes de Trichoderma spp. Frente a Botrytis sp. y testigos
Producto del análisis de varianza se encontró diferencias estadísticas altamente significativas (p ˂ 0.01) en los promedios de áreas de los tratamientos estudiados para la competencia por espacio y nutrientes de Trichoderma spp. frente a Botrytis sp. y testigos, con un coeficiente de variación de 12,13%.
La
prueba de Duncan (![]() =0.05 de
probabilidad) mostro que la mayor área de medio ocupado fue por T. koningii
(MHSJ11) con 24.58 cm2; seguido de T. koningii (MHSJ11) - Botrytis
sp. con 23.81 cm2, T. inhamatum (MOBSHO01) - Botrytis
sp. con 23.44 cm2, T. inhamatum (MOBSHO01) con 23.17 cm2,
T. harzianum (MHMLL04) con 22,58 cm2 y T. atroviride
MHSJ01 vs Botrytis sp. con 21,41 cm2 con diferencias
significativas entre sí, probablemente Trichoderma tenga un mecanismos de
rápida detección de hifas exploratorias y de reconocimiento de exudados del
patógeno. Por otro lado, la cepa T. longibrachiatum (MJHU01) con 2.49 cm2
y T. longibrachiatum (MJHU01) - Botrytis sp. con 1.98 cm2
presentan una ocupación de espacio de desarrollo significativamente inferior al
resto de los tratamientos; posiblemente se deba a que esta cepa sea muy
exigente a condiciones de desarrollo in vitro o no sea muy competitiva
frente a otro hongo.
=0.05 de
probabilidad) mostro que la mayor área de medio ocupado fue por T. koningii
(MHSJ11) con 24.58 cm2; seguido de T. koningii (MHSJ11) - Botrytis
sp. con 23.81 cm2, T. inhamatum (MOBSHO01) - Botrytis
sp. con 23.44 cm2, T. inhamatum (MOBSHO01) con 23.17 cm2,
T. harzianum (MHMLL04) con 22,58 cm2 y T. atroviride
MHSJ01 vs Botrytis sp. con 21,41 cm2 con diferencias
significativas entre sí, probablemente Trichoderma tenga un mecanismos de
rápida detección de hifas exploratorias y de reconocimiento de exudados del
patógeno. Por otro lado, la cepa T. longibrachiatum (MJHU01) con 2.49 cm2
y T. longibrachiatum (MJHU01) - Botrytis sp. con 1.98 cm2
presentan una ocupación de espacio de desarrollo significativamente inferior al
resto de los tratamientos; posiblemente se deba a que esta cepa sea muy
exigente a condiciones de desarrollo in vitro o no sea muy competitiva
frente a otro hongo.
La evaluación del área de desarrollo para cada cepa como testigo y enfrentado con Botrytis no presento similitud a nivel estadístico, siendo las cepas: T. harzianum (MHMLL04) con 22.58 cm2 y T. harzianum (MHMLL04) - Botrytis sp. con 21.14 cm2, T. atroviride (MHSJ01) - Botrytis sp. con 21.41 cm2, T. atroviride (MHSJ01) con 20.84 cm2, T. citrinoviride (MHMLL03) con 19.5 cm2, T. citrinoviride (MHMLL03) - Botrytis sp. con 15.69 cm2, T. atroviride (MHMLL06) con 18.48 cm2, T. atroviride (MHMLL06) - Botrytis sp. con 16.05 cm2, T. harzianum (MCHT07) con 17.79 cm2 y T. harzianum (MCHT07) - Botrytis sp. con 17.07 cm2, T. inhamatum (MOBSHO03) con 16.15 cm2 y T. inhamatum (MOBSHO03) - Botrytis sp. con 12.33 cm2 respectivamente. Excepto para T. longibrachiatum (MJHU01) como testigo y en enfrentamiento. Quizá podría deberse a características genéticas o por falta de competitividad frente a otro hongo. La superioridad de competición por espacio y nutrientes de las cepas de Trichoderma spp. sea condicionado por la tasa de crecimiento, seguido se presentan las mayores tasas de crecimiento para las cepas de Trichoderma: T. koningii (MHSJ11) testigo con 1.49 cm/día; T. koningii (MHSJ11) enfrentado con 1.46 cm/día; T. inhamatum (MOBSHO01) enfrentado con 1.42 cm/día; T. inhamatum (MOBSHO01) testigo con 1.48 cm/día, T. harzianum (MHMLL04) testigo con 1.42 cm/día y T. atroviride (MHSJ01) enfrentado con 1.38 cm/día. Para los resultados anteriores, Ahmad y Baker (1987) mencionan que la competencia por espacio y nutrientes es una característica del controlador biológico favorecida por la velocidad de crecimiento.
3.4. Micoparasitismo
En la escala de evaluación de micoparasitismo (mecanismo de acción antagónica) alcanzado por las cepas de Trichoderma al enfrentarse a Botrytis sp. las cepas: T. koningii (MHSJ11), T. atroviride (MHSJ01), T. atroviride (MOBSHO03), T. koningii (MCHT11), T. atroviride (MHMLL06), T. citrinoviride (MHMLL03), T. inhamatum (MOBSHO01) y T. harzianum (MCHT07) lograron alcanzar la clase 1 de la escala propuesta por Bell et al. (1982), por crecer completamente sobre la colonia de la cepa patógeno Botrytis sp. (MANB01) esto redujo el área de desarrollo y la formación de conidios de Botrytis; posiblemente, las cepas de Trichoderma tienen una mayor capacidad de detección quimiotrópica del patógeno a ello se suma la velocidad de su crecimiento de micelio, sobre el micelio del patógeno Botrytis sp.; en un segundo nivel se tiene a las cepas T. harzianum (MHMLL04), T. harzianum (MOSA05), T. strictipile (MCHPS03), T. strictipile (MCHT04) y T. longibrachiatum (MJHU01) los cuales alcanzaron una clase 2: logrando invadir dos terceras partes de la superficie del medio de cultivo, posiblemente a un menor grado de reconocimiento químico y físico del patógeno Botrytis (figura 2).
Los resultados de micoparasitismo, que incluyen como mecanismo de acción al crecimiento de micelio de las cepas Trichoderma spp. sobre el micelio de Botrytis sp., coinciden con los obtenidos por Elad et al. (1983), quienes evaluaron el micoparasitismo mediante la técnica de cultivos duales (patógeno - antagonista) para las cepas de T. harzianum y T. hamatum con Rhizoctonia solani y Sclerotium rolfsii; determinando el crecimiento del biocontrolador (Trichoderma) sobre el hongo fitopatógeno (R. solani o S. rolfsii). En efecto, el sobrecrecimiento del micelio de Trichoderma (clase 1 de la escala micoparasítica de Bell et al. 1982), es un carácter ventajoso en la disputa de colonizar un área (competición por espacio y nutrientes); esta es una manera de ejercer biocontrol, al reducir o detener completamente el desarrollo del micelio de un patógeno (Denis y Webster, 1971). Consecuentemente, Harman et al. (1981) sugieren que, aunque el micoparasitismo es el principal mecanismo de biocontrol para Trichoderma spp., existen otros como: adhesión y enrollamiento, competencia por nutrientes, reconocimiento, crecimiento quimiotrófico, la antibiosis, producción de antibióticos volátiles.
En la caracterización microscópica del enfrentamiento de cepas de Trichoderma frente Bortrytis, se observó que cuatro cepas de Trichoderma [T. koningii (MHSJ11), T. atroviride (MHSJ01), T. atroviride (MOBSHO03) y T. koningii (MCHT11)] no presentaron interacción hifal de enrollamiento; probablemente estas cepas cuenten con otro otros tipos de acción antagónica como segregación de sustancias quimicas como mencionan McAllister et al. (1994), quienes estudiaron la relación antagónica Trichoderma – Glomus mossae, observaron que, las hifas del biocontrolador en contacto con las del hongo Glomus no las enrollaron, afirmando que el micoparasitismo incluye segregación de antibióticos péptidos. Señalar que en una interacción hifal de enrollamiento posiblemente se dé segregación de sustancias antibióticas y/o enzimáticas. Los estudios realizados por Ochoa (2002) demostraron que las especies de Trichoderma spp. atacan a las hifas del hospedero por enrollamiento: enganchando o aprisionando las estructuras y penetrando la pared celular del hospedero, por secreción de enzimas líticas como proteinasas básicas, β-1,3-glucanasas y quitinasas; en efecto, la actividad antifúngica de las enzimas quitinolíticas tienen un papel importante en la lisis de la pared celular de los hongos fitopatógenos.
A nivel microscópico ocho cepas de Trichoderma [T. atroviride (MHMLL06), T. citrinoviride (MHMLL03), T. harzianum (MOSA05), T. inhamatum (MOBSHO01), T. harzianum (MCHT07), T. strictipile (MCHPS03), T. strictipile (MCHT04) y T. longibrachitum (MJHU01)] presentaron interacción hifal de enrollamiento. Estos resultados fueron similares a los reportados por Elad et al. (2000), quienes observaron ante un microscopio electrónico, enrollamiento de Trichoderma spp. en hifas de varios fitopatógenos, entre ellos Rhizoctonia solani, Sclerotium rolfsii, Fusarium oxysporum f. sp. radicis-lycopersici, Colletotrichum gloeosporioides y B. cinérea entre otros. Consecuentemente ocho cepas [T. atroviride (MHSJ01), T. atroviride (MOBSHO03), T. koningii (MCHT11), T. harzianum (MHMLL04), T. atroviride (MHMLL06), T. citrinoviride (MHMLL03), T. harzianum (MOSA05), T. inhamatum (MOBSHO01), T. harzianum (MCHT07) y T. strictipile (MCHPS03)] presentaron penetración en la hifa de Botrytis. Asimismo, Henis et al. (1983), al describir la acción de Trichoderma spp. sobre esclerocios de Sclerotium rolfssi, resaltan que la capacidad de penetración de las hifas de Trichoderma, esta capacidad anidada un conjunto de mecanismos proprio de cada cepa mejora la eficiencia como un biocontrolador.
![]()
![]()
![]()

Figura 2. Comparativa de la capacidad antagónica por competición de sustrato (medio de cultivo) de Trichoderma spp. frente a Botrytis sp. a los 7 dds. 1. Enfrentamiento de T. koningii (MHSJ11) - Botrytis sp.: 1a. Enfrentamiento en medio PDA, 1b. Actividad lítica 40X; 2. Enfrentamiento de T. atroviride (MHSJ01) - Botrytis sp.: 2a. Enfrentamiento en medio PDA, 2b. Penetración de hifas 100X; 3. Enfrentamiento de T. atroviride (MOBSHO03) - Botrytis sp.: 3a. Enfrentamiento en medio PDA, 3b. Penetración de hifas 100X; 4. Enfrentamiento de T. koningii (MCHT11) - Botrytis sp.: 4a. Enfrentamiento en medio PDA, 4b. Penetración de hifas 100X; 5. Enfrentamiento de T. harzianum (MHMLL04) - Botrytis sp.: 5a. Enfrentamiento en medio PDA, 5b. Penetración de hifas 100X; 6. Enfrentamiento de T. atroviride (MHMLL06) - Botrytis sp.: 6a. Enfrentamiento en medio PDA, 6b. Penetración y enrollamiento de hifas 100X; 7. Enfrentamiento de T. citrinoviride (MHMLL03) - Botrytis sp.: 7a. Enfrentamiento en medio PDA, 7b. Enrollamiento de hifas 100X, 7c. Penetración de hifas 100X; 8. Enfrentamiento de T. harzianum (MOSA05) - Botrytis sp.: 8a. Enfrentamiento en medio PDA, 8b. Penetración de hifas 100X, 8c. Enrollamiento de hifas 100X; 9. Enfrentamiento de T. inhamatum (MOBSHO01) - Botrytis sp.: 9a. Enfrentamiento en medio PDA, 9b. Enrollamiento de hifas 40X, 9c. Penetración de hifas 100X; 10. Enfrentamiento de T. harzianum (MCHT07) – Botrytis sp.: 10a. Enfrentamiento en medio PDA, 10b. Penetración de hifas 100X, 10c. Enrollamiento de hifas 100X; 11. Enfrentamiento de T. strictipile (MCHPS03) - Botrytis sp.: 11a. Enfrentamiento en medio PDA, 11b. Enrollamiento de hifas 40X, 11c. Penetración de hifas 100X; 12. Enfrentamiento de T. strictipile (MCHT04) - Botrytis sp.: 12a. Enfrentamiento en medio PDA, 12b. Enrollamiento de hifas 100X, 12c. Penetración de hifas 100X y 13. Enfrentamiento de T. longibrachitum (MJHU01) - Botrytis sp.: 13a. Enfrentamiento en medio PDA, 13b. Enrollamiento de hifas 100X.
