Anatomía de la madera de Schinus molle L. con tumoraciones en zonas urbanas
Burl wood anatomy of Schinus molle L. in urban areas
José Alberto Cipra Rodriguez1![]() , Angel
Eduardo Montoya Yanavilca1
, Angel
Eduardo Montoya Yanavilca1![]() , Julio Jeanpierre
Adriano Reyes1
, Julio Jeanpierre
Adriano Reyes1![]() , Ximena del Pilar Colán de la Vega1
, Ximena del Pilar Colán de la Vega1![]() , Maricel Jadith
Móstiga Rodríguez1*
, Maricel Jadith
Móstiga Rodríguez1*![]()
1 Universidad Nacional Agraria La Molina, Facultad de Ciencias Forestales, Lima, Perú
*Autor de Correspondencia, e-mail: mmostiga@lamolina.edu.pe
Recibido, 18/12/2019 Aceptado, 14/02/2020 DOI:10.25127/aps.20201.545

RESUMEN
Schinus molle L. es una especie nativa bastante usada en los arboricultivos limeños. En los fustes y ramas de algunos de estos árboles se han observado tumoraciones, las cuales no son características de esta especie forestal. Con el fin de describir las características anatómicas de la madera de tumor se ha estudiado tanto la madera de tumor como la madera normal. Las muestras fueron tomadas de ramas del arbolado del campus de la Universidad Nacional Agraria La Molina (UNALM). Las características organolépticas de la madera de tumor son: color amarillo con manchas rojizas oscuras, textura fina, grano ondulado, y brillo, veteado y olor ausente. Las características macroscópicas son: porosidad difusa, agrupamiento de poros en múltiples radiales y en racimos, parénquima axial difuso en agregados y radios escasamente visibles. Las características microscópicas son: diámetro tangencial total de poro 68 µm, 81 poros por milímetro cuadrado, longitud de elemento vascular 203 µm, altura de radio 293 µm, ancho de radio 37 µm, 14 células en la altura de radio, 2 células en el ancho de radio, 10 radios por milímetro, diámetro total de fibra 18 µm, espesor de pared de fibra 4.33 µm, y longitud de fibra 653 µm.
Palabras claves: Anatomía de la madera, tumor, molle serrano, zonas urbanas, UNALM
ABSTRACT
Schinus molle L. is a native species widely used in Lima arboricultures. In stems and branches of some of these trees, burls have been observed, which are not characteristic of this forest species. In order to describe the anatomical characteristics of the tumoral wood, both the tumoral wood and the normal wood have been studied. Samples were taken from branches of the National Agrarian University La Molina (UNALM) campus trees. The organoleptic characteristics of the tumoral wood are: yellow color with dark reddish spots, fine texture, wavy grain, and brightness, veining and absent smell. The macroscopic characteristics are: Wood diffuse-porous, vessel grouping in radial multiples of 4 or more and in clusters, axial parenchyma diffuse-in-aggregates and rays scarcely visible. The microscopic characteristics are: total tangential diameter of vessel 68 μm, 81 vessels per square millimeter, vessel element length 203 μm, ray height 293 μm, ray width 37 μm, 14 cells in ray height, 2 cells in ray width, 10 rays per milimeter, total diameter of fibre 18 μm, fibre wall thickness 4.33 μm, and fiber length 653 μm.
Keywords: Wood anatomy, burl, molle serrano, urban áreas, UNALM
I. INTRODUCCIÓN
La ciudad de Lima alberga diversas especies forestales que constituyen el arbolado urbano, siendo una de los más representativas la especie Schinus molle L. (SERPAR, 2012), que brindan múltiples beneficios (Goodwin, 2017), como el efecto termorregulador, la captación de partículas suspendidas (Bulnes et al., 2017), la regulación del ciclo hidrológico, el mejoramiento de la calidad del aire, la captura de carbono, el aumento del valor de bienes inmuebles, la mejora estética, y la generación de sombra, (Song et al., 2018), además favorece la salud pública (Donovan 2017).
S. molle, conocido como Molle serrano, pertenece a la familia Anacardiaceae (Alba et al., 2009). Se distribuye naturalmente desde México hasta América del Sur, pasando por Colombia, Ecuador, Perú y en la zona interandina de Bolivia, hasta Chile, Argentina, Paraguay y Uruguay (Barkley, 1944, Barkley, 1957, Schulte et al., 1992, Crivellaro y Schweingruber, 2013, Bulnes et al., 2017). Se encuentra en zonas semiáridas y en los valles interandinos, donde es capaz de crecer en áreas bastantes secas, con varios meses sin lluvias. Está ausente en la parte más cálida y húmeda de su área de distribución y rehúye a las cercanías del mar. Su distribución vertical, según la latitud geográfica, oscila entre los 2000 hasta los 3900 m.s.n.m. (Schulte et al., 1992). Asimismo, se ha cultivado en diferentes partes del mundo (Barkley, 1944), inclusive hasta naturalizarse (Nel et al., 2004).
Esta especie es un árbol ornamental siempreverde, con velocidad de crecimiento de moderado a rápido, resistente al calor y a la sequía (Bulnes et al., 2017; Nel et al., 2004). Puede alcanzar diámetros de 30 a 80 cm, y alturas de 3 a 15 m (Barkley, 1944, Schulte et al., 1992, Bulnes et al. 2017), con ramas colgantes (Crivellaro y Schweingruber, 2013). Presenta un fuste de sinuoso a irregular y nudoso, aunque a veces es recto y cilíndrico en su primera longitud (Schulte et al., 1992, Bulnes et al., 2017). La corteza externa de fustes y ramas es agrietada, de color grisáceo, con placas pequeñas que a menudo se desprenden solas (Bulnes et al., 2017). La corteza interna es de color rosado blanquecino, y a veces tiene un poco de secreción blanquecina, con tenue olor resinoso (Reynel y Marcelo, 2009). Emite raíces fasciculadas a una profundidad media (Bulnes et al., 2017). Tiene una copa amplia, abundante, e irregular de forma semiesferoidal a globosa (Schulte et al., 1992, Bulnes et al., 2017).
Este árbol se utiliza principalmente para el ornamento por la belleza de su copa colgante; la renovación de hojas, que favorece a la reducción de partículas contaminantes en el aire; y la generación de sombra, que permite la aparición de algunas aves y el crecimiento de plantas de menor tamaño en el sotobosque (Bulnes et al., 2017, Nel et al., 2004).
S. molle es considerado una especie resistente al ataque de plagas y enfermedades. Tiene como plaga conocida al insecto monófago picador-chupador Calophya schini, “psilido del molle”, cuyo daño consiste en la generación de agallas a lo largo de los foliolos, raquis y ramas tiernas, que provoca la deformación y caída prematura de hojas (Móstiga, 2014). Por otra parte, se ha observado en diferentes partes de la ciudad de Lima la presencia de excrecencias a lo largo del fuste y ramas de los árboles de S. molle. Estos crecimientos excesivos son conocidos como “burls” (término en inglés), que en este artículo serán denominados “tumores” por ser el término en español que mejor se ajusta. De igual manera, este término ha sido empleado por Orellana (2014) en su estudio de enfermedades en diferentes especies, entre ellas S. molle, en La Molina, Lima.
Los tumores son hinchamientos anormales pronunciados en una planta leñosa que típicamente ocurren en los tallos y ramas, y pueden variar en tamaño (Allen et al., 2010). Estos pueden ser causados por ciertos insectos y organismos infecciosos, síntesis desregulada de auxina y citoquinina, también por estrés ambiental o predisposición genética (Eom y Chung, 1994, Allen et al., 2010, Bergdahl y Hill, 2016). Los árboles de todas las edades y tamaños pueden verse afectados, y pueden aparecer tanto en un solo árbol como en grupos (Allen et al., 2010). Los impactos en el crecimiento del árbol son mínimos (Allen et al., 2010). Asimismo, los árboles con tumores son genéticamente más resistentes a la pudrición porque su formación es antagónica a la descomposición por microorganismos (Crane et al., 1995).
La madera de tumor posee todos los elementos celulares que se encuentran en la madera normal (Chattaway, 1958), pero presenta diferencias en la proporción de estos (Carlquist, 1978, James, 1984) y también en la estructura anatómica (El Mouridi et al., 2011, Kilic et al., 2012).
El propósito de este estudio es describir la anatomía de la madera a nivel macroscópico y determinar las dimensiones microscópicas de las células de la madera de los tumores de S. molle presente en el campus de la Universidad Nacional Agraria La Molina (UNALM) de la ciudad de Lima, Perú.
II. MATERIAL Y MÉTODOS
Área de estudio
El estudio se realizó en el campus de la UNALM, que cuenta con un área aproximada de 220 ha, ubicada en el distrito de La Molina (Lima – Perú). Presenta una temperatura anual promedio de 20°C, humedad relativa promedio de 84%, y una precipitación media anual de 119 mm (según datos del Observatorio Meteorológico Alexander von Humboldt, UNALM). La topografía está conformada por una terraza de superficie plana, con pendiente de 1%, un drenaje moderado, y permeabilidad y profundidad también moderadas (Alvares et al., 2001). En sus inicios el riego en el campus fue por gravedad, pero, entre los años 2016 y 2017, cambió al riego por aspersión. Esta modificación, motivó la realización de podas agresivas de raíces en el arbolado para la instalación de tuberías. Asimismo, las labores culturales que se han observado en el campus no se realizaron con la técnica adecuada en algunos casos, como las constantes podas drásticas o de rejuvenecimiento, el uso de herramientas inapropiadas para las podas como el machete, entre otras.
Población y muestra
La población de árboles de S. molle en la UNALM supera los 200 individuos, de los cuales, se observaron que más del 50% presentan tumoraciones en fustes y ramas (Figura 1). Debido a que la investigación consideró métodos no destructivos, los criterios de selección para la obtención de muestras fueron: árboles con necesidad de poda de ramas primarias, árboles con un Diámetro a la Altura del Pecho (DAP) promedio de 20 cm, altura promedio de 5 m y presencia de tumores. Este estudio utilizó la madera proveniente de la poda de tres individuos de edades contemporáneas: un árbol con tumor en las ramas primarias y dos árboles sin tumores (testigos).

Figura 1. Tumores en el fuste y las ramas en S. molle dentro del campus de la UNALM.
Estudio de anatomía de la madera
El estudio de la anatomía de la madera se llevó a cabo en el mes de mayo del 2017 en el Laboratorio de Anatomía e Identificación de la Madera del Departamento Académico de Industrias Forestales (DAIF) de la Facultad de Ciencias Forestales (FCF) de la UNALM. Las muestras de madera estudiadas se obtuvieron a partir de las podas de ramas de árboles de S. molle normales y con tumores en ramas y fustes (Figura 2).

Figura 2. Porción de rama con tumor de S. molle.
La metodología utilizada para este estudio fue la empleada en el Laboratorio de Anatomía e Identificación de la Madera DAIF-FCF (Chavesta y Huamán 2013) y la descripción anatómica se basó en lo estipulado por IAWA Committee (Wheeler et al., 1989).
Caracterización organoléptica
La determinación de las características organolépticas se utilizó muestras de madera de 5 cm x 5 cm x 5 cm en orientación transversal, radial y tangencial. Las características organolépticas evaluadas fueron el color de albura y duramen, el olor, el grano, la textura, el veteado, y el brillo de la madera.
Caracterización macroscópica
La determinación de las características macroscópicas se utilizó las mismas probetas mencionadas. Para la adecuada visualización se alisó las superficies de las probetas con una cuchilla y se humedeció con un poco de agua. Luego, con ayuda de una lupa de 10x se observó la porosidad, el agrupamiento de poros, el parénquima y los radios.
Caracterización microscópica
Para la caracterización microscópica se requirió de cuatro etapas previas: preparación de las láminas histológicas, preparación de láminas de tejido macerado, registros microfotográficos y mediciones de los elementos xilemáticos; los cuales se detallan a continuación:
Preparación de láminas histológicas
Se inició con la preparación de las muestras que constan de dos cubitos de madera de madera normal y dos de madera de tumor, cuatro en total de 1 cm x 1 cm x 2,5 cm perfectamente orientados en sus tres planos de corte. El proceso comprendió los siguientes pasos:
- Ablandamiento: Los cubitos se ablandaron con agua a 180 °C por un periodo de 6 horas al día por tres semanas. Se determinó el ablandamiento de los cubos mediante la presión ejercida con la uña del dedo.
- Corte de láminas: los cubitos ablandados se cortaron en láminas de 20 – 25 µm de espesor en sus tres secciones con ayuda del micrótomo de deslizamiento horizontal.
- Deshidratación: Las láminas se colocaron en forma secuencial en alcohol de 30°, 60° y 90°. Estas permanecieron 15 min en cada grado de alcohol, al término se retiró y agregó un grado superior de alcohol.
- Coloración: Después de ello, se adicionó 5-6 gotas de safranina para colorear las láminas, se esperó 15 – 20 min para que se uniformice el color. Luego, se lavó con alcohol de 90° dos veces consecutivas. Finalmente se adiciona xilol para fijar el colorante.
- Montaje: las láminas cuadradas se posicionaron correctamente en el portaobjeto, se agregó una gota del pegamento merkoglass a cada lámina y se colocó el cubreobjeto. El pegamento es de secado instantáneo.
Preparación de láminas de tejido macerado
Se prepararon palitos de madera similares a los palitos de fósforo y se siguió como se explica a continuación:
- Maceración: Los palitos de madera se colocaron en un vaso de 100 ml, donde se adicionó ácido nítrico al 33% para su cocción a 180°C durante 15 minutos en una cocina eléctrica. Los palitos estaban listos cuando se decoloraron y presentaron una consistencia blanda.
- Lavado, coloración y montaje: El tejido se lavó con agua corriente entre 5 o 6 veces para eliminar el ácido, seguido se agregó alcohol de 90°. Luego se incorporó 3 – 4 gotas de safranina. Posterior a eso se colocó en una placa Petri y se agregó xilol para fijar el colorante. Después, se separaron las fibras y los vasos con pinza, aguja hipodérmica y pincel con ayuda de un microscopio. Finalmente, los vasos y fibras seleccionadas se colocaron en portaobjetos, donde se agregó una gota de merkoglass y se cubrió con un cubreobjetos.
Registros microfotográficos
Una vez obtenidas las láminas histológicas y de tejido macerado de S. molle se procedió al registro microfotográfico con el microscopio Leica DM500 y el programa Image Tool 3.0. Se obtuvieron registros suficientes para conseguir muestras de fibras y vasos en las láminas de tejido macerado, mientras que en las láminas histológicas se tomaron las microfotografías necesarias para cubrir toda el área de la lámina.
Mediciones de los elementos xilemáticos
Se realizaron 50 mediciones de cada característica microscópica con el Software Image Pro Plus Versión 4.5. Los parámetros medidos y analizados en las láminas histológicas fueron: diámetro tangencial total de poros, frecuencia de poros por milímetro cuadrado, longitud de radios, ancho de radios, número de células en altura de radios, número de células en ancho de radios, y número de radios por milímetro. Mientras que en las láminas de macerado: diámetro total de fibra, espesor de pared de fibra, longitud de fibra, y longitud de vaso.
Análisis estadístico
El análisis estadístico se realizó mediante el programa MINITAB 18. El cumplimiento de supuestos de normalidad de errores se verificó con la prueba Kolmogórov-Smirnov (también llamada prueba K-S) y la de homogeneidad de variancias con la prueba F de Fisher para datos con distribución normal y la prueba de Levene para los otros. La comparación de las medias se realizó a través de la prueba de T de Student para las variables que cumplieron con los supuestos, y la prueba de la U de Mann-Whitney para las otras variables.
III. RESULTADOS Y DISCUSIÓN
Caracterización organoléptica
La madera de S. molle normal, en condición seca al aire, tiene la albura de color amarillo y el duramen rojizo. Su textura es fina, de grano inclinado, y de brillo, veteado y olores ausentes. Por otro lado, la madera de tumor es de color amarillo con manchas rojizas oscuras, de textura fina y de grano ondulado. El brillo, veteado y olor también están ausentes en este tipo de madera (Figura 3).

Figura 3. Sección transversal de una rama con tumor
Cabe destacar que a causa de la pérdida de humedad se observaron deformaciones ligeras en las probetas de madera de tumor; sin embargo, esta particularidad se notó con mayor claridad en probetas de mayores dimensiones (2,5 x 2,5 x 35 cm) (Figura 4). Esta característica está relacionada con el grano ondulado, el cual se origina por la severa desorganización de la orientación de las células fusiformes del cambium (Wloch et al., 2001; Gülsoy et al., 2005), y porque se produce un mayor número de células por anillo de crecimiento (Crane et al., 1995) generando un tejido irregular (Tsoumis et al., 1988). Además, las deformaciones resultan del giro de las células entre sí (Kilic et al., 2012) provocando que en la sección transversal las células cambien de posición de transversal a longitudinal, y en la sección tangencial, se organicen en forma de huella dactilar (Gülsoy et al., 2005, Kilic et al., 2012) ocasionando la contorsión de la madera (Carlquist, 1978).

Figura 4. Deformación en probetas de madera de tumor de S. molle.
Es preciso mencionar que tanto la deformación del tejido xilemático como de la corteza externa del S. molle sugiere la posibilidad de una lesión al cambium vascular (Larson, 1994, Arbellay et al., 2012).
Caracterización macroscópica
A nivel macroscópico, tanto la madera normal como la madera de tumor presentan porosidad difusa, agrupamiento de poros en múltiples radiales de 4 o más y en racimo, parénquima axial difuso en agregados y radios poco visibles a simple vista. Estas características coinciden con lo mencionado por Schulte et al. (1992), Moglia y Gimenez (1998) y Crivellaro y Schweingruber (2013) para madera normal. Respecto a la madera de tumor, James (1984) indica que esta contiene más parénquima axial que la normal; sin embargo, esta característica no se observó en las probetas a simple vista ni con la lupa de 10x.
Cabe mencionar que se observó a simple vista un mayor número de poros en la madera de tumor que en la madera normal. Esto puede explicar porque en la primera los poros son más anchos que en la segunda (Carlquist, 1978) ocasionando que el observador perciba un mayor número de poros en la madera de tumor.
Caracterización microscópica
A nivel microscópico (Figura 5), los poros tienen un diámetro tangencial total mayor en la madera de tumor (51 µm ± 17µm) que en la madera normal (68 µm ± 28 µm) y lo inverso sucede con el número de poros por milímetro cuadrado, es decir, la madera normal (130 ± 40) tienen más poros por unidad de área que la madera de tumor (81 ± 38). Estas mismas características encontró Carlquist (1978) en la madera tumoral en las especies de la familia Bruniaceae. En contraste, Gülsoy et al. (2005) observaron lo contrario en la madera de tumor de Quercus robur subsp. robur (Fagaceae).
En cuanto al elemento vascular de S. molle, la madera de tumor (203 µm ± 116 µm) es más largo que la madera normal (185 µm ± 152 µm). Por otro lado, Carlquist (1978), Crane et al. (1995) y Gülsoy et al. (2005) mencionan que el elemento vascular es más pequeño y deforme en la madera tumoral que en la madera normal.
Respecto a los radios, la medida (madera de tumor 293 µm ± 88 µm, normal 306 µm ±71 µm) y el número de células (madera de tumor 14 ± 5, normal 13 ± 4) en la altura no son diferentes entre las maderas. En otro sentido, Gülsoy et al. (2005) indican que la altura de los radios es menor en la madera de tumor. En la medida (madera de tumor 37 µm ± 7 µm, normal 47 µm ± 9 µm) y el número de células (madera de tumor 2 ± 0, normal 3 ± 1) en el ancho, la madera normal presenta valores superiores al de la madera de tumor, mientras que, Carlquist (1978) menciona lo contrario. Por otro lado, el número de radios por milímetro (madera de tumor 10 ± 2, normal 9 ± 2) es indistinto entre las maderas.
En el caso de las fibras, el diámetro total (madera de tumor 18 µm ± 5 µm, normal 17 µm ± 3 µm) y la longitud (madera de tumor 653 µm ± 108 µm, normal 637 µm ± 95 µm) es igual en ambas maderas; sin embargo, Carlquist (1978), Tsoumis et al. (1988), Crane et al. (1995) y Gülsoy et al. (2005) mencionan que las fibras de la madera de tumor son más cortas, irregulares y deformes, para sus estudios en tumores de especies de la familia Bruniaceae, Erica arbórea (Ericaceae), Populus tremuloides (Salicaceae) y Quercus robur subsp robur (Fagaceae), respectivamente. Por otro lado, el espesor de madera es mayor en la madera de tumor (4,33 ± 1 µm) que en la normal (3,93 ± 1 µm). Tal relación fue encontrada por El Mouridi et al. (2011) y El Alami et al. (2013), en sus estudios de tumores en Tetraclinis articulata (Cupressaceae).
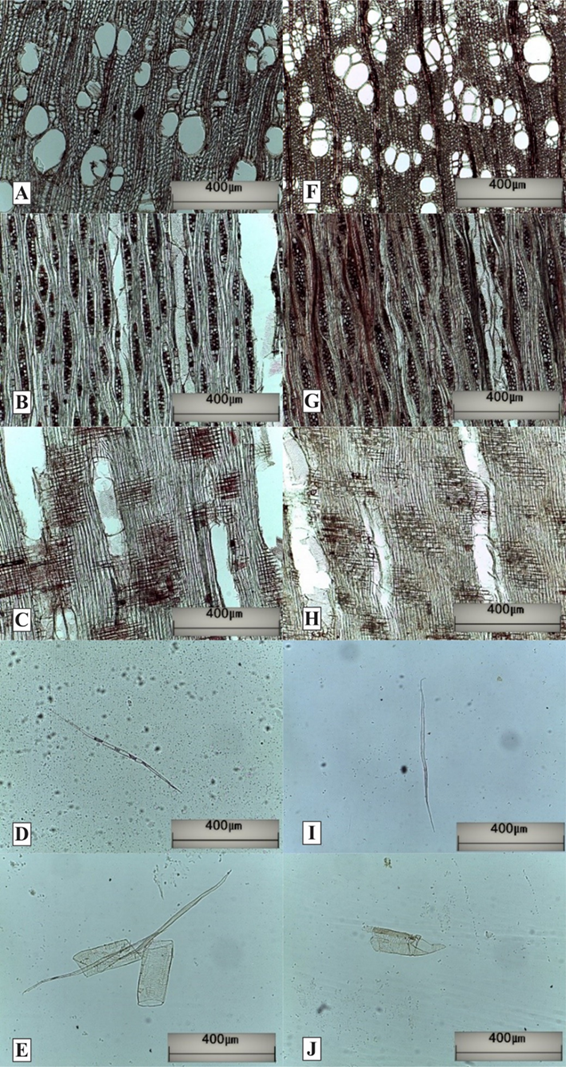
Figura 5. A-E, Microfotografías de la madera de tumor de S. molle. F-J, Microfotografías de la madera normal de S. molle. A y F, Sección transversal (poros). B y G, Sección tangencial (radios). C y H, Sección radial (radios). D e I, fibra de la madera. E y J, elemento vascular. *Vista 100X
En la Tabla 1 se presenta los resultados obtenidos en la presente investigación de la caracterización microscópica con los valores encontrados por Crivellaro y Schweingruber (2013), Young (1974), Schulte et al. (1992) y Moglia y Gimenez (1998) para madera normal de S. molle provenientes tanto de zonas urbanas, donde se le ha introducido, como en su área de distribución natural. Esta comparación muestra que las medidas de los elementos anatómicos de la madera de tumor de S. molle están comprendidos entre los valores expuestos por los otros autores.
Tabla 1. Medidas de los elementos anatómicos de la madera de S. molle del presente estudio junto con los de Crivellaro y Schweingruber (2013), Young (1974), Schulte et al. (1992) y Moglia y Gimenez (1998)
|
Mediciones de elementos anatómicos |
Zona urbana |
Distribución natural |
|||||
|
Madera de tumor |
Madera normal |
||||||
|
Presente Estudio |
Crivellaro y Schweingruber (2013) |
Young (1974) |
Schulte et al. (1992) |
Moglia y Gimenez (1998) |
|||
|
Poros |
Diámetro tangencial total (µm) |
68,28 |
50,65 |
20-50 |
62 |
68.8 |
51,7 |
|
Número por mm2 |
81 |
130 |
100-200 |
473 |
28.8 |
120 |
|
|
Radio |
Altura(µm) |
292,57 |
305,95 |
- |
162-324 |
580 |
- |
|
Ancho (µm) |
36,78 |
46,98 |
- |
26 |
- |
- |
|
|
Número de células en la altura |
14 |
13 |
- |
- |
6-50 |
- |
|
|
Número de células en el ancho |
2 |
3 |
1-3 |
- |
1-3 |
- |
|
|
Número por mm |
10 |
9 |
4-12 |
- |
8 |
- |
|
|
Fibras |
Diámetro total (µm) |
18,16 |
16,91 |
- |
- |
18.51 |
- |
|
Espesor de la pared (µm) |
4,33 |
3,93 |
Delgados a gruesos |
- |
3.88 |
- |
|
|
Longitud (µm) |
653,46 |
637,01 |
- |
605 |
770 |
- |
|
|
Vasos |
Longitud (µm) |
203,24 |
184,74 |
200-500 |
272 |
- |
290 |
A manera de resumen se presenta en la Tabla 2 los resultados del estudio de la anatomía de la madera de tumor de rama de la especie S. molle.
Tabla 2. Características organolépticas, macroscópicas y microscópicas de la madera de tumor comparada con madera normal de la especie S. molle.
|
Madera de tumor |
Madera normal |
|||
|
Características |
Color de la albura |
Amarillo |
Amarillo con manchas rojizas oscuras |
|
|
Color del duramen |
Rojizo |
|||
|
Textura |
Fina |
Fina |
||
|
Grano |
Ondulado |
Inclinado |
||
|
Brillo |
Sin brillo |
Sin brillo |
||
|
Veteado |
Ninguno |
Ninguno |
||
|
Olor |
Ninguno |
Ninguno |
||
|
Características |
Porosidad |
Difusa |
Difusa |
|
|
Agrupamiento de Poros |
Múltiples radiales de 4 o más y en racimos |
Múltiples radiales de 4 o más y en racimos |
||
|
Parénquima |
Difuso en Agregado |
Difuso en Agregado |
||
|
Radios |
Escasamente Visibles |
Escasamente Visibles |
||
|
Características |
Poros |
Diámetro
tangencial total |
68A1 (100;10;28) |
51B (90;24;17) |
|
Número por mm2 |
81A (155;30;38) |
130B (247;76;40) |
||
|
Radios |
Altura (µm) |
293A (530;171;88) |
306 A (540;193;71) |
|
|
Ancho (µm) |
37A (59;24;7) |
47B (70;25;9) |
||
|
Número de
células |
14 A (27;7;5) |
13 A (24;8;4) |
||
|
Número de
células |
2 A (3;2;0) |
3 B (4;2;1) |
||
|
Número por |
10 A (14;5;2) |
9 A (14;5;2) |
||
|
Fibras |
Diámetro total |
18 A (27;8;5) |
17A (23;9;3) |
|
|
Espesor de pared
|
4.33 A (7;2;1) |
3.93 B (6;2;1) |
||
|
Longitud (µm) |
653 A (1001;391;108) |
637 A (873;440;95) |
||
|
Vasos |
Longitud (µm) |
203 A (981;126;116) |
185 B (947;61;152) |
|
1Promedio de 50 repeticiones; valor máximo, valor mínimo y desviación estándar del promedio entre paréntesis; promedios en una columna con letras diferentes son significativamente diferentes a un nivel de probabilidad del 5 %.
IV. CONCLUSIONES
La madera de tumor proveniente del árbol S. molle tiene las características organolépticas: color amarillo con manchas rojizas oscuras, textura fina, grano ondulado, y brillo, veteado y olor ausente. Las características macroscópicas que presenta son: porosidad difusa, agrupamiento de poros en múltiples radiales de 4 o más y en racimos, parénquima difuso en agregados y radios escasamente visibles. Las características microscópicas son: diámetro tangencial total de poro 68 µm, 81 poros por milímetro cuadrado, longitud de elemento vascular 203 µm, altura de radio 293 µm, ancho de radio 37 µm, 14 células en la altura de radio, 2 células en el ancho de radio, 10 radios por milímetro, diámetro total de fibra 18 µm, espesor de pared de fibra 4.33 µm, y longitud de fibra 653 µm.
V. AGRADECIMIENTOS
Al Vicerrectorado de Investigación y al Vicerrectora Académico de la UNALM por el financiamiento otorgado. También al Mg. Sc. Manuel Chavesta y al Laboratorio de Anatomía e Identificación de la Madera de la UNALM por permitirnos utilizar sus instalaciones y equipos. Finalmente, al Mg. Sc. Rolando Montenegro por su apoyo en el procesamiento estadístico.
VI. REFERENCIAS BIBLIOGRÁFICAS
Alba A., P. Bonilla y J. Arroyo. 2009. “Actividad cicatrizante de una pomada con aceite esencial de Schinus molle L. “Molle” en ganado vacuno con heridas infectadas y en ratones”. Ciencia e Investigación 12 (1): 29-36.
Allen, K., J. Blodgett, K. Burns, R. Cain, S. Costello, T. Eager, J. Harris, B. Howell, R. Mask, W. Schaupp, J. Witcosky, y J. Worrall. 2010. Field guide to diseases & insects of the rocky mountain región. Fort Collins (EE. UU,): U.S. Department of Agriculture, Forest Service.
Alvares, G., M. Ferreyra, B. Huamantinco y R. Prieto. 2001. Diagnóstico de la gestión integral y propuesta dé desarrollo para el Jardín Botánico "Octavio Velarde Núñez" de la Universidad Nacional Agraria La Molina. Informe de Investigación. Lima (Perú).
Arbellay, E., P. Fonti y M. Stoffel. 2012. “Duration and extensión of anatomical changes in Wood structure after cambial injury”. Journal of Experimental Botany 63 (8): 3271-3277. DOI: 10.1093/jxb/ers050.
Barkley, F.A. 1944. “Schinus L”. Brittonia 5 (2): 160-198.
Barkley, F.A. 1957. “A study of Schinus L”. Lilloa (28): 5-110.
Bergdahl, A. y A. Hill. 2016. Diseases of trees in the Great Plains Informe Técnico. Fort Collins (EE. UU,)
Bulnes, F., M. Orrego y A. Terán. 2017. Árboles y palmeras del vivero forestal: características, requerimientos y recomendaciones de 40 especies para la arboricultura urbana. Lima (Perú): Universidad Nacional Agraria La Molina
Carlquist, S. 1978. “Wood anatomy of Bruniaceae: correlations with ecology, phylogeny, and organography”. Aliso 9 (2): 323-364.DOI: 10.5642/aliso.19780902.10.
Chattaway, M. 1958. “Bud development and lignotuber formation in eucalypts”. Australian Journal of Botany 6:103-115. DOI: 10.1071/BT9580103.
Chavesta, M. y D. Huamán. 2013. Microtecnia de la madera: manual de prácticas. Lima (Perú): Universidad Nacional Agraria La Molina
Crane, P., Y. Hiratsuka y P. Blenis. 1995. “Black stem galls on aspen: anatomy and histochemistry”. Canadian Journal of Botany 73 (3): 391-412. DOI: 10.1139/b95-041.
Crivellaro, A. y F. H. Schweingruber. 2013. “Atlas of Wood, bark and pith anatomy of Eastern Mediterranean trees and shrubs with special focus on Cyprus.” New York (United States): Springer-Verlag Berlin Heidelberg. DOI: 10.1007/978-3-642-37235-3.
Donovan, G. 2017. “Including public-health benefits of trees in urban-forestry decisión making”. Urban Forestry & urban Greening 22: 120-123. http://dx.DOI.org/10.1016/j.ufug.2017.02.010.
El Alami, S., M. El Mouridi, T. Laurent, G. Calchéra, A. Famiri, A. Hakam, B. Kabouchi y J. Gril. 2013. “Fracture energy of Wood and root burl Wood of thuya (Tetraclinis articulata)”. Journal of Tropical Forest Science 25 (2): 166-174.
El Mouridi, M., T. Laurent, A. Famiri, B. Kabouchi, T. Alméras, G. Calchéra, A. El Abid, M. Ziani, J. Gril y A. Hakam. 2011. “Physical characterization of the root burl wood of thuja (Tetraclinis articulata (Vahl) Masters)”. Physical Chemical News 59: 57-64.
Eom, Y., y Y. Chung. 1994. “Tumor Wood anatomy in korean red pine (Pinus densiflora)”. International Association of Wood Anatomists Journal 15 (2):149-155. DOI: 10.1163/22941932-90001354.
Goodwin, D. 2017. The urban tree. London (United Kingdom): Routledge. DOI: 10.4324/9781315266169.
Gülsoy, S., H. Eroğlu y N. Merev. 2005. “Chemical and Wood anatomical properties of tumorous Wood in a turkish White oak (Quercus robur subsp. robur)”. International Association of Wood Anatomists Journal 26(4): 469-476. DOI: 10.1163/22941932-90000128
James, S. 1984. “Lignotubers and burls – their structure, function and ecological significance in Mediterranean ecosystems”. The Botanical Review 50 (3): 225-266. DOI: 10.1007/BF02862633.
Kilic, A., S. Gülsoy, E. Windeisen, H. Jeske y G. Wegener. 2012. “Characterizing of abnormal formation in hardwood”. European Journal of Wood and Wood Products 70: 373-375. DOI: 10.1007/s00107-011-0527-1.
Larson, P. 1994. The Vascular Cambium. Development and Structure. Berlin (Germany): Springer Series in Wood Science.
Moglia, G. y A. Gimenez. 1998. “Rasgos anatómicos característicos de hidrosistemas de las principales especies arbóreas de la región chaqueña argentina”. Investigación agraria. Sistemas y recursos forestales 7 (1-2): 53-72
Móstiga, M. 2014. Prospección y evaluación de los insectos y ácaros perjudiciales en especies forestales del campus de la Universidad Nacional Agraria La Molina. Tesis de Grado. Universidad Nacional Agraria La Molina (UNALM). Lima (Perú).
Nel, J., D. Richardson, M. Rouget, T. Mgidi, N. Mdzeke, D. Le Maitre, B. Van Wilgen, L. Schonegevel,L. Henderson y S. Neser. 2004. “A proposed classification of invasive alien plant species in South Africa: towards prioritising species and areas for management action.” South Africa Journal of Science 100: 53-64.
Orellana, G. 2014. Prospección y evaluación de síntomas y signos de enfermedades en especies forestales del campus de la Universidad Nacional Agraria La Molina. Tesis de Grado. Universidad Nacional Agraria La Molina (UNALM). Lima (Perú).
Reynel, C. y J. Marcelo. 2009. “Árboles de los ecosistemas forestales andinos: manual de identificación de especies”. Serie Investigación y Sistematización (9): 14-19.
Schulte, A., C. Rojas y R. Rojas. 1992. Reforestación y agroforestería en los andes: uso sostenido, conservación y restauración de suelos con árboles y arbustos nativos: Apuntes sobre el molle (Schinus molle L.). Cochabamba (Bolivia)
SERPAR (Servicio de Parques de Lima). 2012. Árboles de Lima. Lima (Perú): Walter H. Wust.
Song, X. P., P. Y. Tan, P. Edwards, y D. Richards. 2018. “The economic benefits and costs of trees in urban forest stewardship: A systematic review”. Urban Forestry & urban Greening 29: 162-170. DOI: 10.1016/j.ufug.2017.11.017.
Tsoumis, G., N. Kezos, I. Fanariotou, E. Voulgaridis y C. Passialis. 1988. “Characteristics of briarwood”. Holzforschung 42(2): 71-77. DOI: 10.1515/hfsg.1988.42.2.71.
Wheeler, E., P. Baas y P. Gasson. 1989. “IAWA List of microscopic features for hardwood identification”. International Association of Wood Anatomists Bulletin n.s. 10(3): 219-332.
Wloch, W., E. Mazur y P. Kojs. 2001. “Intensive change of inclination of cambial initials in Picea abies (L.) Karst. tumours. Trees 15: 498-502. DOI: 10.1007/s00468-001-0127-5.
Young, D. 1974. “Comparative Wood anatomy of Malosma and related genera (Anacardiaceae)”. Aliso 8 (2): 133-146. DOI: 10.5642