Control de la contaminación microbiana empleando bajas concentraciones de ozono e hipoclorito de sodio al interior de contenedores de polietileno empleados en biorreactores de inmersión temporal
Control of microbial contamination using low concentrations of ozone and sodium hypochlorite inside of polyethylene containers used as temporary immersion bioreactor
Henri Delgado Haya1*![]() , Alexander
Altamirano Salazar1, Mar
Asunción Gárate Navarro1
, Alexander
Altamirano Salazar1, Mar
Asunción Gárate Navarro1![]() , Juliana
Rodríguez García1, Marco Antonio León Martínez2
, Juliana
Rodríguez García1, Marco Antonio León Martínez2![]()
1 Instituto Nacional de Innovación Agraria, Estación Experimental Agraria El Porvenir San Martín, Tarapoto, Perú
2 Instituto de Investigación Biológica de las Cordilleras Orientales, Tarapoto, Perú
* Autor para correspondencia: henri.delgado12@gmail.com
Recibido, 23/02/202020 Aceptado, 15/03/2020 DOI:10.25127/aps.20201.510

RESUMEN
El propósito del trabajo de investigación fue caracterizar y aislar yemas axilares de piña a partir de cormos, y utilizarlos como explantes para su diferenciación en plantas enteras. Después de cuatro subcultivos consecutivos, plantas individuales fueron acondicionadas dentro de contenedores de sistemas de inmersión temporal para su establecimiento y multiplicación. Como segundo propósito de nuestra investigación fue evaluar el efecto antimicrobiano de cuatro diferentes concentraciones (mg) de ozono y cuatro diferentes concentraciones de hipoclorito de sodio NaOCl (%) al interior de contenedores de polietileno utilizados para la multiplicación de plantas en un sistema de inmersión temporal. Nuestros resultados demuestran que el acondicionamiento in vitro de yemas axilares procedente de cormos de piña, consiguen diferenciarse en plantas totalmente enteras e independientes hasta los 120 días. Asimismo, la utilización de ozono superior a 100 mg/contenedor disminuye la contaminación microbiana, así como, la utilización de una mayor concentración de 0,05% de cloro activo. Sugiriendo que la utilización de bajas concentraciones de ozono e hipoclorito de sodio garantiza la inocuidad interna de recipientes de polietileno frágiles a recibir elevadas temperaturas (autoclavado) como un método tradicional de esterilización.
Palabras clave: piña, ozono, hipoclorito de sodio, sistemas de inmersión temporal.
ABSTRACT
The purpose of this research was characterize and isolate the axillary buds of pineapple from corm, and use them as explants for their differentiation in whole plants. After four consecutive subcultures, individual plants were conditioned inside to containers of temporary immersion systems for their establishment and multiplication. As the second purpose of our research was to evaluate the antimicrobial effect of four different concentrations (mg) of ozone and four different concentrations of sodium hypochlorite NaOCl (%) inside of polyethylene containers used for plant multiplication in a temporary immersion system. Our results show that the in vitro establishment of axillary buds from pineapple corms, can be differentiated in completely whole and independent plants up to 120 days. Furthermore, the use of ozone more than 100 mg/container decreases microbial contamination, as well as the use of a higher concentration of 0.05% of active chlorine. Suggesting that the use of low concentrations of ozone and sodium hypochlorite ensures the internal safety of fragile polyethylene containers to receive high temperatures (autoclaving) as a traditional method of sterilization.
Key words: pineapple, ozone, sodium hypochlorite, temporal immersion system.
I. INTRODUCCIÓN
El cultivo de tejidos vegetales o cultivo in vitro es considerado como una herramienta biotecnológica empleada en la micropropagación de plantas a gran escala y en espacios reducidos. Donde cada explante, considerado como cualquier porción vegetal explota su potencial intrínseco o inducido (Thorpe, 1981). La maximización de la micropropagación va más allá de un cultivo in vitro convencional. El uso de biorreactores para la micropropagación de plantas es un método que tiene como objetivo la multiplicación masiva de plantas, muchas veces con un enfoque de industria en la propagación de plantas. La contaminación es uno de los principales problemas a resolver en cultivo in vitro, puede originarse de dos fuentes distintas: aquellos provenientes de la superficie o tejidos de la planta donadora y aquellos que surgen como resultados de fallas en los procedimientos de laboratorio. En las últimas décadas, el foco en investigación se ha realizado sobre la toxicidad, contaminación industrial, en agricultura buscando soluciones de bajo costo (Yagub et al., 2014); se han buscado interacciones con el oxígeno, fibra asociada a la radiación plasma (Hassan y Carr, 2019), así mismo, se ha visto interesantes efectos de los agentes contaminantes en membranas naturales (Liu et al., 2011). Tratamientos basados en bio compuestos para el tratamiento de la contaminación en frutas, tienen limitaciones en la propagación de enfermedades por el alto costo (Liu et al., 2017). La presencia de agentes contaminantes afecta el normal desarrollo de los explantes establecidos a condiciones in vitro haciendo indispensable el uso de metodologías que permitan su eliminación (Goodburn y Wallace, 2013), así como el uso de nano celulosa y nano fibrillas celulosas para su eliminación (Kumar et al., 2019), por otro lado en los últimos años el uso de irradiación, alta temperatura e hibridación han sido métodos empleados para el mismo fin (Law et al., 2014). El uso de agentes oxidantes como hipoclorito de sodio (NaOCl), hipoclorito de mercurio (HgCl2) y ozono (O3) han sido empleados en inúmeros trabajos con fines experimentales y/o industriales utilizando recipientes menores a 5L (Saxena et al., 2003). El uso de recipientes de mayor capacidad, como los utilizados en biorreactores resultan tener una mayor complicación (Ma et al., 2017), cuando se quiere realizar una esterilización interna (Zhao et al., 2013). Esto debido a su gran tamaño y al material con que podría ser fabricado (no autoclavable), buscando controlar metodologías de esterilización de recipientes (Ogunsona et al., 2019), en experimentos realizados para contenedores de antioxidantes (Dias et al., 2018), y el uso del ozono para la industria alimenticia (Kim et al., 2003). Con la finalidad de buscar una metodología de esterilización de recipientes de mayor capacidad (contenedores), que excluya la posibilidad de usar un autoclave, el objetivo de la investigación fue estudiar el efecto antimicrobiano de pequeñas concentraciones de hiplocorito de sodio (%) y ozono (mg), lo cual fue probado con micro bacterias en distribuciones con agua (Vaerewijck et al., 2014) durante el establecimiento y multiplicación in vitro de plántulas de piña de la variedad MD-2 Golden obtenidos de cuatro subcultivos consecutivos, de acuerdo a la recomendación los últimos estudios para eliminar concentración de patógenos en vegetales (Niemira y Fan, 2014). Los resultados sugieren que pequeñas concentraciones de hipoclorito de sodio y ozono inhibe el crecimiento de contaminantes al interior de contenedores utilizados en biorreactores de inmersión temporal de una manera dosis dependiente.
II. MATERIALES Y MÉTODOS
El estudio se realizó en el Laboratorio de Biotecnología Vegetal de la Estación Experimental Agraria “El Porvenir” - San Martín del Instituto Nacional de Innovación Agraria – INIA, ubicado en el Distrito de Juan Guerra, San Martín, Perú.
Material vegetal
Brotes axilares de piña de la variedad MD-2 Golden fueron extraídos de plantas maduras identificadas en parcelas de agricultores de la provincia de Moyobamba, departamento de San Martín. Estos brotes fueron sumergidos en una solución fungicida-insecticida (1g/L de Benomyl + 1mL/L de alphacypermetrina) por 15 minutos y expuestos bajo sombra para su secado por un lapso de 5 días, luego de este tratamiento los brotes fueron llevados al laboratorio para un posterior tratamiento. Estos brotes fueron cortados en dos partes (superficial y basal) a fin de quedarse con la región intermedia donde se concentra la región del cormo con yemas no diferenciadas. La región intermedia fue lavada en constante agitación con agua y detergente por un intermedio de 10 minutos. Enseguida esta región intermedia fue tratada con 2 mL/L de Kasumin (kasugamicina) por 20 minutos y luego lavadas para retirar las brácteas y exponer el cormo. El cormo resultante fue lavado y nuevamente tratado con 2mL/L de Kasumin por un intervalo de 10 minutos con menor frecuencia de agitación a fin de evitar un daño sobre las yemas axilares expuestas. Luego de este tratamiento el cormo fue lavado por dos veces y llevado a desinfección en la cámara de flujo laminar. El trabajo de desinfección fue llevado por dos tiempos, el primero consistió en colocar el cormo en una solución de 1% de hipoclorito de sodio por un intervalo de 20 minutos en constante agitación y luego enjuagados por tres periodos de 1 minuto con agua destilada estéril. Luego, fueron extraídas las yemas axilares con una buena proporción del tejido basal (cormo), estas yemas axilares fueron nuevamente tratadas con 0,5% de hipoclorito de sodio por un intervalo de 5 minutos y posteriormente enjuagados por tres periodos con agua destilada estéril. Finalmente, fue eliminado el tejido basal afectado por el desinfectante y las yemas fueron inoculadas en un medio de cultivo líquido en agitación (65 rpm) para su diferenciación. La diferenciación y multiplicación de estas yemas durante cuatro subcultivos por 8 meses permitió obtener plántulas y clusters óptimos para ser multiplicadas en un biorreactor de sistema de inmersión temporal.
Condiciones de cultivo
Para la diferenciación de yemas y multiplicación de brotes fueron empleados medios de cultivo líquido compuesto por sales minerales, en concreto el medio Murashige & Skoog, a media concentración (diferenciación) y concentración completa (multiplicación) enriquecidos con vitaminas y reguladores de crecimiento para cada etapa. Diferenciación: Thiamine-HCl 0,4 mg/L + ácido nicotínico 0,5 mg/L + 6-bencil amino purina (BAP) 3 mg/L + 10% (v/v) de endospermo líquido de coco + sacarosa 30 g/L. Multiplicación: Thiamine-HCl 0,4 mg/L + ácido nicotínico 0,5 mg/l + 6-bencil amino purina (BAP) 2 mg/L + ácido naftalen acético (ANA) 0,3mg/L + sacarosa 30 g/L. Ambos medios de cultivo fueron llevados a un pH de 5,8. Las condiciones de crecimiento para las dos etapas (diferenciación y multiplicación) fue a una temperatura de 24 ± 2 ºC, fotoperiodo de 16/8 e intensidad luminosa de 800 lux. A diferencia de la etapa de multiplicación, las yemas que inician el proceso de diferenciación fueron expuestas inicialmente a una condición de oscuridad total por 48 horas.
Desinfección de contenedores
Los contenedores destinados a alojar medio de cultivo y plántulas fueron lavados con agua jabonosa (solución de detergente 5g/L de agua) y enjuagados con agua no destilada y agua destilada. Después de su secado, fueron sometidos a diferentes tratamientos de pequeñas concentraciones de agentes antimicrobianos como hipoclorito de sodio: 0%; 0,025%; 0,05% y 0,075% y la inyección de ozono: 0; 50; 100; 150 y 200 mg. Todos estos agentes antimicrobianos fueron aplicados al interior de los contenedores por 5 min para el hipoclorito de sodio y 7,5; 15; 22,5 y 30 min para 50, 100, 150 y 200 mg de ozono. Después de este tratamiento los recipientes fueron expuestos por 30 minutos en el interior de las cámaras de flujo laminar con el objeto de volatilizar los restos del hipoclorito de sodio y el ozono aplicados.
Sistema de inmersión temporal (multiplicación)
Explantes (plántulas) que fueron acondicionados en contenedores para multiplicación recibieron una programación de inmersión de cuatro minutos por frecuencias repetidas de cuatro horas. El sistema estuvo constituido por dos recipientes de plástico de 4 litros cada uno (un contenedor de medio de cultivo y otro contenedor de plántulas), los dos recipientes conectados por una manguera de plástico flexible constituyen una unidad experimental. El flujo de aire generado por un compresor fue microfiltrado (filtros de venteo de 0,2 µm) y conducido al interior del contenedor del medio de cultivo que mediante presión interna hizo posible la transferencia del medio de cultivo hacia el segundo recipiente de explantes. Terminada la inmersión, el flujo de aire fue invertido y por consiguiente una transferencia del medio hacia su contenedor original. El tiempo y frecuencia de inmersión fue controlado por un temporizador digital.
Diseño y análisis estadístico
Fue empleado un diseño estadístico completamente al azar (DCA) (Sanz y Vera, 2015), compuesto por cuatro tratamientos para el experimento de hipoclorito de sodio y cinco tratamientos para el experimento de ozono (Castro, 2014). Ambos experimentos tuvieron un total de cuatro repeticiones. Cada unidad experimental estuvo compuesta por un biorreactor (contenedor de medio de cultivo, contenedor de explante y conexiones). Los datos obtenidos fueron trabajados en Excel y llevando a la construcción de gráfico de barras, “en comparación de una proporción con la proporción teórica de 0.50 que representaría la mediana” (Parker y Vannest, 2009).
III. RESULTADOS Y DISCUSION
Obtención de plántulas de piña (Ananas comosus Merr) Cv. MD2 vía organogénesis
Para el empleo de sistemas de inmersión temporal que persigan fines de maximización en la multiplicación de plantas, es necesario contar con explantes iniciales. Basada en esta premisa fueron colectados brotes de piña (Figura 1A), exponiendo el cormo libre de bracteas (Figura 1B) y la individualización de yemas axilares (Figura 1C).

Figura 1. Yemas axilares obtenidas a partir de brotes de piña (Ananas comosus) Cult. MD2. A, Brote. B, Cormo. C, Yema axilar (explante). Escala 1 cm.
Las yemas incubadas individualmente en medio de cultivo después de un procedimiento de desinfección consiguieron diferenciarse en plántulas y clusters individuales por periodos de 40 a 70 días respectivamente (Figura 2A, 2B), un tiempo óptimo para obtener plántulas individuales (Fig 2C), apropiadas para iniciar su multiplicación en un biorreactor de sistema de inmersión temporal.

Figura 2. Individualización de plántulas de piña a partir de clusters unificados. A, Cluster de piña mantenidos en envases de polipropileno. B, Cluster de plántulas de piña. C, Plántula de piña utilizada para la multiplicación en BITs. Escala 1 cm.
![]() La
diferenciación de yemas axilares de piña ha sido hasta ahora la única vía
satisfactoria para la multiplicación de plantas dentro del grupo de las
bromeliáceas (Be & Debergh, 2006; Mhatre, 2007).
Un resultado que también ha sido evidenciado en esta investigación sobre
condiciones in vitro. Esta diferenciación es conocida como morfogénesis,
documentada en muchas especies vegetales y valorada como una formación discreta
de órganos o plantas enteras, muy empleada para estudios básicos en botánica,
bioquímica, propagación, mejoramiento y desarrollo de cultivos transgénicos
(Phillips, 2004).
La
diferenciación de yemas axilares de piña ha sido hasta ahora la única vía
satisfactoria para la multiplicación de plantas dentro del grupo de las
bromeliáceas (Be & Debergh, 2006; Mhatre, 2007).
Un resultado que también ha sido evidenciado en esta investigación sobre
condiciones in vitro. Esta diferenciación es conocida como morfogénesis,
documentada en muchas especies vegetales y valorada como una formación discreta
de órganos o plantas enteras, muy empleada para estudios básicos en botánica,
bioquímica, propagación, mejoramiento y desarrollo de cultivos transgénicos
(Phillips, 2004).
Utilización de ozono en recipientes de bioreactores de sistema de inmersión temporal
El establecimiento in vitro de explantes, está asociado la inocuidad del explante al método adecuado para la esterilización de recipientes, medio de cultivo y materiales que son empleados durante los procedimientos realizados. Se sabe que el método más empleado para la esterilización de recipientes de biorreactores es realizado a vapor con una presión de 1 atm (autoclavado). Sin embargo, este método tiene una limitación en cuanto al tamaño de los recipientes y el material con los que son fabricados (vidrio, polietileno, policarbonato, etc). Sobre este escenario se realizó pruebas de inyección de ozono dentro de recipientes de polietileno a diferentes concentraciones en mg, evaluándose la contaminación a posteriori por hasta 28 días. Los resultados sugieren que concentraciones superiores a los 50 mg de ozono, inhibe el desarrollo de microorganismos contaminantes. A partir de los 100 mg de ozono inyectado, la inhibición de crecimiento de microrganismos es absoluta. Contrariamente, la ausencia del ozono favorece su desarrollo en el tiempo, registrándose una contaminación del 25%, 50% y 75% a los 7, 14, 21 y 28 días después de su establecimiento (Figura 3).

Figura 3. Efecto de diferentes concentraciones de ozono (O3) en la desinfección de recipientes BITs. Evaluación de % de contaminación realizados a los 7, 14, 21 y 28 días después de su inoculación de explantes. Barras con diferentes colores muestran diferentes concentraciones de ozono (mg).
Utilización de hipoclorito de sodio en recipientes de bioreactores de sistema de inmersión temporal
Además de la utilización de ozono para inhibir el desarrollo de microorganismos, hubo interés en si concentraciones menores al 1% de hipoclorito de sodio, podrían tener un efecto inhibitorio en el desarrollo de microorganismos contaminantes. Los resultados demuestran que concentraciones superiores a 0,025% de cloro activo inhibe el desarrollo de microrganismos contaminantes para recipientes de polietileno usados en biorreactores de sistemas de inmersión temporal, teniendo una inhibición total cuando se emplea 0,075% de hipoclorito de sodio. La usencia de hipoclorito promueve el desarrollo de microorganimos hasta un 100% 21 días después de su acondicionamiento (Figura 4).
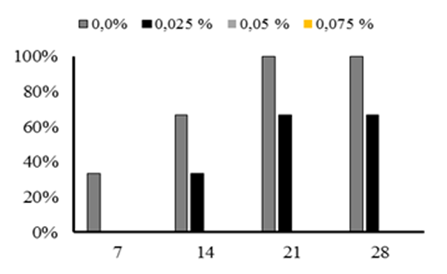
Figura 4. Efecto de diferentes concentraciones de hipoclorito de sodio (NaClO) en la desinfección de recipientes BITs. Evaluación de % de contaminación realizados a los 7, 14, 21 y 28 días después de su inoculación de explantes. Barras con diferentes colores muestran diferentes concentraciones de hipoclorito de sodio (%).
El empleo de 100 mg de ozono o 0,075% de cloro activo, inhibe al 100% el crecimiento de microorganismos contaminantes. Este resultado puede ser empleado dentro de un proceso de micropropagación in vitro que utilice contenedores mayores a 5L.
El éxito para el establecimiento in vitro de explantes, es aquella condición en donde no se tenga la presencia de microorganismos. Muchos compuestos son empleados para la reducción y/o eliminación de estos contaminantes, entre ellos el ozono y el hipoclorito de sodio, dos compuestos que tienen una acción desinfectante. El ozono por ejemplo es considerado un poderoso desinfectante oxidante de amplio espectro (Loeb, 2011), al igual que el efecto oxidante con efecto blanqueador del hipoclorito de sodio (Vianna et al., 2004).
El empleo de pequeñas concentraciones de estos dos componentes resulta ser muy importante para la micropropagación, tal es así que pequeñas concentraciones de los dos agentes oxidantes estudiados (hipoclorito al 0,075% y ozono 100 mg), tienen la capacidad de poder inhibir el crecimiento de microorganismos contaminantes. Su incremento por ejemplo en un 1% - 2% hipoclorito de sodio, puede generar el quemado del tejido (Silva et al., 2015; Yildiz & Er, 2002), por lo que es necesario su remoción mediante numerosos enjuagues consecutivos. Contrariamente al hipoclorito de sodio, si hubiese un exceso de ozono puede ser removido con mayor facilidad por ser un gas. Finalmente, la exposición de estos compuestos en elevadas concentraciones y por periodos largos puede acarrear a un stress fisiológico que conlleva a la producción de etileno y maduración de órganos (Cardarelli y Cardona, 2017), una característica fisiológica que no fue evidenciada en el estudio.
IV. CONCLUSIONES
El empleo de bajas concentraciones superiores a 100 mg ozono y 0,075% de hipoclorito de sodio, inhibe satisfactoriamente el crecimiento de contaminantes microbianos al interior de recipientes de polietileno frágiles a recibir elevadas temperaturas (autoclavado).
V. REFERENCIAS BIBLIOGRÁFICAS
Be, L. V., y P. C. Debergh. 2006. “Potential low-cost micropropagation of pineapple (Ananas comosus). ” South African Journal of Botany 72 (2): 191-194.
Cardarelli, M., y C. M. Cardona. 2017. “Influence of ozone treatments on in vitro propagation of Lilium in bioreactor.” Acta Horticulturae. 1155: 381-386
Castro, M. E., 2019. “Bioestadística aplicada en investigación clínica: conceptos básicos. ” Revista Médica Clínica Las Condes 30 (18): 50-65.
Dias, T., M. G. Alves, B. M. Silva, y P. F. Oliveira. 2018. “Nutritional Factors and Male Reproduction”. En Encyclopedia of Reproduction. Skinner, M. K. (ed). Massachusetts (EE.UU.): Academic Press
Goodburn, C., y C. A. Wallace. 2013. “The microbiological efficacy of decontamination methodologies for fresh produce: A review.” Food Control 32 (2): 418-427
Hassan, M. M., y C. M. Carr. 2019. “A review of the sustainable methods in imparting shrink resistance to wool fabrics.” Journal of Advanced Research 18. 39-60.
Kim, J. G., A. Yousef, y M. A Khadre. 2003. “Ozone and its current and future application in the food industry.” Advances in Food and Nutrition Research 45: 167-218
Kumar, V., P. Pathak, y N. K. Bhardwaj. 2019. “Waste paper: An underutilized but promising source for nanocellulose mining.” Waste Management 102 (1): 281-303.
Law, C. L., Chen, H. H. H., y Mujumdar A. S. 2014. “Food Technologies: Drying”. En Encyclopedia of Food Safety. Motarjemi, Y., G. Moy, E. Todd (eds). Massachusetts (EE.UU.): Academic Press
Liu, F., N. A. Hashim, Y. Liu, M. R. Moghareh Abed, y K. Li. 2011. “Progress in the production and modification of PVDF membranes.” Journal of Membrane Science 375 (1–2): 1-27.
Liu, M., A. Thygesen, J. Summerscales, y A. S. Meyer. 2017. “Targeted pre-treatment of hemp bast fibres for optimal performance in biocomposite materials: A review.” Industrial Crops and Products 108: 660-683.
Loeb, B. L. 2011. “Ozone: Science & Engineering: Thirty-Three Years and Growing.” Ozone: Science & Engineering. 33: 329-342.
Niemira, I., y X. Fan. 2014. “Advances in Processing Technologies to Preserve and Enhance the Safety of Fresh and Fresh-Cut Fruits and Vegetables” En Encyclopedia of Food Microbiology. Batt, C. A. y M. L. Tortorello (eds). Massachusetts (EE.UU.): Academic Press
Ma, L., M. Zhang, B. Bhandari, y Z Gao. 2017. “Recent developments in novel shelf life extension technologies of fresh-cut fruits and vegetables.” Trends in Food Science & Technology 64: 23-38
Mhatre, M. 2007. “Micropropagation of pineapple, Ananas comosus (L.) Merr” En Protocols for micropropagation of woody trees and fruits. Jain, S. M. y H. Häggman (eds). Dordrecht (Netherlands): Springer
Ogunsona, E. O., R. Muthuraj, E. Ojogbo, O. Valero, y T. H. Mekonnen. 2019. “Engineered nanomaterials for antimicrobial applications: A review.” Applied Materials Today 18: 100473
Parker, R. I. y K. Vannest. 2009. “An improved effect size for single case research: NonOverlap of All Pairs.” Behavior Therapy 40 (4): 357-367.
Phillips, G. C. 2004. “In vitro morphogenesis in plants-recent advances.” In Vitro Cellular & Developmental Biology – Plant 40: 342-345.
Sanz, J., y G. Vera. 2015. “Técnicas para el análisis de diseños de caso único en la práctica clínica: ejemplos de aplicación en el tratamiento de víctimas de atentados terroristas.” Clínica y Salud 26 (3): 167-180.
Saxena, J., H. Gourama, S. L. Cuppett, y L. B. Bullerman. 2003. “Controlled-atmosphere storage: applications for bulk storage of foodstuff” En Encyclopedia of Food Sciences and Nutrition. Caballero, B., L. Trugo, y P. M. Finglas (eds). San Diego (EE.UU.): Academic Press.
Silva, L. C., R. Paiva, D. P. Vargas, D. P. Correa da Silva, S. Barbosa, y R. C. Herrera. 2015. “Decontaminant solution on in vitro growth of Byrsonima intermedia seedlings.” Ciencia Rural Santa Maria 45 (4): 674-679.
Thorpe, T. A. 1981. Plant tissue culture: methods and applications in agriculture. New York (EEUU): Academic Press
Vaerewijck, M., G. Huys, J. C. Palomino, J. Swings, y F. Portaels. 2014. “Mycobacteria in drinking water distribution systems: ecology and significance for human health.” FEMS Microbiology Reviews 29: (5)911-934.
Vianna, M. E., B. P. F. Gomes, V. B. Berber, A. A. Zaia, C. C. R. Ferraz, y F. J. de Souza-Filho. 2004. “In vitro evaluation of the antimicrobial activity of chlorhexidine and sodium hypochlorite.” Oral Surgery, Oral Medicine, Oral Pathology, Oral Radiology, and Endodontology. 97 (1): 79-84.
Yagub, M. T., T. K. Sen, S. Afroze, y H.M. Ang. 2014. “Dye and its removal from aqueous solution by adsorption: A review.” Advances in Colloid and Interface Science 209: 172-184.
Yildiz, M., y C. Er. 2002. “The effect of sodium hypochlorite solutions on in vitro seedling growth and shoot regeneration of flax (Linum usitatissimum).” Naturwissenschaften 89:259-261.
Zhao, C., J. Xue, F. Ran, S. Sun. 2013. “Modification of polyethersulfone membranes – A review of methods.” Progress in Materials Science 58 (1): 76-150