Comparación de modelos para estimar el área foliar en pasto Cayman (Brachiaria hybrido)
Comparison of models to estimate the leaf area in Cayman grass (Brachiaria hybrido)
Danny Villegas1![]() , Nora Valbuena
Torres1, Manuel Milla2*
, Nora Valbuena
Torres1, Manuel Milla2*![]() , Yamir
Terán1, Yary Pérez Pérez3
, Yamir
Terán1, Yary Pérez Pérez3![]() , Salli
Villegas Rivas1, Wilfredo Ruiz Camacho4
, Salli
Villegas Rivas1, Wilfredo Ruiz Camacho4![]() , Ángel
Paredes Guerrero2
, Ángel
Paredes Guerrero2
1 Programa de Ciencias del Agro y del Mar, Universidad Nacional Experimental de los Llanos Occidentales “Ezequiel Zamora”, Carrera 3 Calle 17, Guanare, Portuguesa, Venezuela.
2 Facultad de Ingeniería Civil, Universidad Nacional de Jaén (UNJ), Calle Cuzco N° 250, Jaén, Cajamarca, Perú-
3 Programa Nacional de Formación Agroalimentaria, Universidad Politécnica Territorial de Portuguesa “JJ Montilla” Avenida Circunvalación Sur, Sector Bellas Artes, Diagonal a la Cruz Roja, Acarigua 3301,, Guanare, Venezuela.
4 Facultad de Ingeniería Forestal y Ambiental, Universidad Nacional de Jaén (UNJ), Calle Cuzco N° 250, Jaén, Cajamarca, Perú.
*Autor de Correspondencia, e-mail mmilla@unj.edu.pe
Recibido, 01/08/2019 Aceptado, 16/08/2019 DOI:10.25127/aps.20192.492
![]()
RESUMEN
Estimar el área foliar es parte fundamental en ensayos con especies forrajeras. En tal sentido, la presente investigación se centró en comparar modelos para estimar el área foliar en pasto Cayman (Brachiaria hybrido), los cuales tienen como premisa fundamental evitar el uso de métodos destructivos. Para tales fines se llevó a cabo un ensayo durante la época seca en una finca destinada a la explotación bovina de cría y ceba con pasto Brachiaria hybrido cv. Cayman. La estimación del área foliar se realizó a través de modelos de regresión lineal (simple, múltiple y con interacción) en función del ancho y largo de la hoja. Los resultados mostraron que el parámetro que determina el área foliar en pasto B. hybrido cv. Cayman es el largo de la hoja. Así mismo, el mejor modelo para estimar el área foliar en éste hibrido es el modelo cubico expresado como .función del largo de la hoja. Finalmente, la metodología empleada en esta investigación sugiere que, además del coeficiente de determinación del modelo (R2), los mejores criterios para seleccionar modelos para la estimación del área foliar en pasto B. hybrido cv. Cayman son el índice de entropía (AIC) y el error estándar residual (EER).
Palabras clave: gramíneas forrajeras, regresión lineal, superficie foliar, entropía, error estándar residual.
ABSTRACT
Keywords: forage grasses, linear regression, leaf surface, entropy, residual standard error.
I. INTRODUCCIÓN
En investigaciones en el área agronómica, en cultivos, plantaciones forestales, y en especial en plantas forrajeras es de vital importancia para los investigadores estimar parámetros como la biomasa foliar y el área foliar. Estos parámetros son fáciles de medir y están muy correlacionados con la tasa de crecimiento del cultivo (Evans, 1972; Poorter y Remkes, 1990; Korner, 1991; Cornelissen et al., 1996). Los fisiólogos vegetales, los biólogos y los agrónomos demostraron la importancia del área foliar en la estimación de crecimiento vegetal, en la determinación de etapas fenológicas, en la estimación del potencial de rendimiento biológico y agronómico, en el cálculo del uso eficiente de la radiación solar, como también en el cálculo del uso eficiente del agua y de la nutrición mineral (Sonnentag et al., 2008). El área foliar es una de las principales variables que afectan el crecimiento de las plantas, por favorecer cambios en la razón del área foliar y en la eficiencia fotosintética en el uso del nitrógeno (Bulynck et al., 1999). Según Sastre et al., (2002) definen el área foliar como la sumatoria de la superficie de tejidos fotosintéticamente activos (hojas, lígulas, tallos) existentes por unidad de superficie del terreno. El área foliar se asocia con muchos procesos agronómicos y fisiológicos que incluyen el crecimiento, fotosíntesis, transpiración, fotones entre la percepción y el balance de energía. Así mismo, la estimación del área foliar constituye un índice importante para establecer la capacidad de las plantas para interceptar la luz, realizar fotosíntesis y producir finalmente bienes agrícolas (Galindo y Clavijo, 2007). Además, es uno de los parámetros más importantes en la evaluación del crecimiento de las plantas; de esta manera, la determinación adecuada de la misma es fundamental en la intersección de los procesos de una especia vegetal.
La determinación del área foliar, se puede realizar por métodos directos e indirectos. Dentro del primer grupo, se destacan las mediciones de hojas a partir de siluetas formadas por los bordes, las cuales, son estampadas en papel y, luego, se miden sus atributos, ya sea por la relación peso: área de figuras circulares o cuadradas, o por fotocopiado sobre papel milimetrado; este método ha sido usado, históricamente, con altos niveles de precisión y con facilidades de realizarlo sin muestreo destructivo (Roos, 1981; Jonckheere et al., 2004). Sin embargo, la mayor desventaja consiste en que la medición es casi imposible de realizar en hojas divididas y con figuras irregulares; tampoco es aplicable para acículas de coníferas, aunque sirve como referencia para probar otras metodologías (Roberts et al., 2005). Existen métodos estándares, donde las hojas se aproximan a figuras geométricas regulares, cuyas áreas son fáciles de calcular (Kucharik et al., 1998; Levy y Jarvis, 1999). La alta velocidad para realizar mediciones es la principal ventaja, pero tienen la dificultad de ser muy poco precisos y la subjetividad a la hora de escoger la forma geométrica adecuada en hojas, que, por lo general, son irregulares. Esto conlleva a que las mediciones no representen la realidad del tamaño del área foliar de la planta.
Los planímetros y las cámaras digitales son usados en la actualidad como métodos indirectos de medición del área foliar (Jonckheere et al., 2004; Eriksson et al., 2005). Los primeros presentan ciertas ventajas, como rapidez para obtener datos y alta eficiencia en el procesamiento de muestras, pero no son precisos, debido, principalmente, a las propiedades ópticas de la hoja y la dependencia de fuentes de energía. Cuando los instrumentos son estáticos, se requiere de muestreo destructivo y en algunos casos, cuando son portables, no pueden ser usados con hojas de gran tamaño en la lámina foliar (Beerling y Fray, 1990). El mayor problema de las imágenes tomadas con cámara digital es el ángulo foliar, el cual, en la mayoría de ocasiones, no es totalmente plano, hecho que produce altos niveles de error procedimental (Craig-Macfarlane et al., 2007). Los métodos de cálculo consisten en aproximar en alto grado el área de la hoja, mediante regresiones de tipo lineal. También pueden ser relaciones logarítmicas, exponenciales o de otro tipo, donde la medición de un atributo, ya sea el largo de la lámina foliar, el ancho de la hoja o los dos combinados, representen un factor altamente dependiente, que al ser multiplicado por un coeficiente, arroje como resultado el valor muy cercano al real (Nautival et al., 1990; Cittadini y Peri 2006; Peksen, 2007). Normalmente, se realizan pruebas estadísticas de alta sensibilidad para validar el modelo (Demirsoy et al., 2005). Este método tiene enormes ventajas, puesto que reduce el muestreo destructivo, permite valorar un mayor número de muestras y no depende de equipos ni condiciones, como electricidad y energía de trabajo. En tal sentido, el objetivo central de este trabajo es comparar modelos para estimar el área foliar en pasto Cayman (Brachiaria hybrido), los cuales tienen como premisa fundamental evitar el uso de métodos destructivos.
II. MATERIAL Y MÉTODOS
Metodología
Ubicación del estudio
El estudio se realizó en la finca Palma Sola localizada en el municipio Papelón, sector Palma Sola ubicada entre 450570,307 longitud Oeste 985346,992 Latitud Norte, destinada a la explotación bovina de cría y ceba. El clima presentó una precipitación promedio anual de 1847,3 mm, los meses más lluviosos ocurren durante abril – septiembre y los secos de enero a marzo; la temperatura oscila entre 26 y 30 ºC, la zona se caracteriza como Bosque seco Tropical (Holdridge, 1978). La investigación se realizó durante la época seca (Enero a Abril, 2017)
Suelos
Se tomaron al azar tres muestras compuestas (0-20 cm profundidad) por tres sub muestras cada una, las cuales se unieron por color y textura , se utilizó un barreno Riverside Eijkelkamp (Cuchara de Ø 50 x 200 mm). Las muestras fueron llevadas al laboratorio de Suelos de la UNELLEZ- Guanare para realizar análisis de rutuna reforzada. Las características químicas del suelo se determinaron bajo los siguientes métodos: pH (potenciómetro), conductividad eléctrica por el método conductimétrico, materia orgánica (Walkey y Black, 1934), fósforo (Olsen et al.,, 1954), Calcio y Magnesio por absorción atómica (Van, 1980), Potasio por fotometría de llama (AOAC 1990). Textura a través del método de Boyucus separadas en Arcilla, Limo y arena. Los resultaron indicaron que los suelos presentan pH (4,6) fuertemente ácido, materia orgánica baja (0,06 %), fosforo bajo (8,6 ppm), potasio medio (106,0 ppm), calcio bajo (976,0 ppm), magnesio bajo (282,0 ppm), textura arcillo limosa (AL), por lo que presenta características de un suelo acido infértil.
Comportamiento Agronómico
Material Vegetal
Se escogió un área mono especifica con pasto B. hybrido cv. Cayman con dimensiones de 900 m2 (30 x 30) con un año de sembrada, el material utilizado fue semilla certificada incrustada comercial de B. hybrido cv. Cayman distribuida por la Empresa Papalotla con pureza de 95 % y viabilidad de 85 %.
Descripción del experimento y tratamientos
Se escogió un lote de terreno, el cual fue cercado y se controló las malezas con herbicidas para hoja ancha durante el estudio. Antes de delimitar las parcelas se uniformizó la pastura con una rotativa a 15 cm del suelo. Posteriormente se dividió en cuatro bloques de 150 m2 (30 m x 5 m), el estudio se realizó en la época seca.
Los cuatro bloques (50 m2 área total y efectiva 90 m2) correspondieron a las repeticiones, con una separación de 1,00 m por los extremos para evitar efecto bordura. Cada bloque se dividió en cinco parcelas (16 m2 área efectiva) distribuidas al azar, que correspondieron con el intervalo entre cortes (21, 28, 35 42 y 49 días).
Área foliar
Antes del corte de uniformidad se seleccionaron y cortaron 150 hojas al azar de cada área de estudio (Figura 1). A cada hoja se determinó lo largo desde la lígula hasta el ápice, la medida se realizó con una regla en centímetros, el ancho se midió del punto medio del largo de la hoja, se utilizó una regla en centímetros (Figura 2), y el área foliar se calcó sobre un papel milimetrado la silueta de cada lamina foliar sin causar daño ni destrucción del tejido; posteriormente se midió el área contando directamente los cuadros englobados en el perímetro de la hoja en cm2 (Schaeffer-Noveli y Cintrón, 1986).

Figura 1. Hojas de B. hybrido cv. Cayman seleccionadas al azar.

Figura 2. Medición del largo y ancho de B. hybrido cv. Cayman.
La estimación del área foliar se realizó a través de modelos de regresión lineal (simple, múltiple y con interacción) en función del ancho y largo de la hoja seleccionada al azar (Tabla 1).
Tabla 1. Modelos considerados para estimar el área foliar en pasto B. hibrido cv. Cayman en función del largo y ancho de la hoja.
|
Modelo |
|
|
Lineal simple
|
|
|
Cuadrático
|
|
|
Cubico
|
|
|
Lineal simple
|
|
|
Cuadrático
|
|
|
Cubico
|
|
|
Lineal múltiple
|
|
|
Lineal múltiple con interacción
|
III. RESULTADOS Y DISCUSIÓN
En el Tabla 2 y las Figuras 3 y 4 se muestra una comparación de modelos para estimar el área foliar en pasto B. hybrido cv. Cayman en función del largo y ancho de la hoja. Allí se observa que, los modelos simple, múltiple, cuadrático y cubico que consideran como variables regresoras, bien sea únicamente el largo de la hoja, o el largo y ancho simultáneamente, fueron los que mostraron el mejor ajuste (R2=0,98), mientras que, aquellos modelos que consideran solo el ancho de la hoja reportaron problemas de falta de ajuste, con coeficientes de determinación entre (R2=0,14 y 0,21). No obstante, a la hora de seleccionar el modelo más adecuado para estimar el área foliar en pasto B. hybrido cv. Cayman en función del largo y ancho de la hoja, los criterios que miden la entropía (AIC) y el error estándar residual (EER) nos permiten tener una mejor visión al respecto, con lo cual se puede sugerir que el mejor modelo para estimar el área foliar en éste hibrido es el modelo cubico (Areafoliar = β0+ β1largo + β2largo2 + β3largo3), ya que, además de reportar un coeficiente de determinación elevado (R2=0,98), es el modelo que muestra la menor entropía (AIC=378,71) y el menor EER (1,43). De allí que, dentro del grupo de modelos considerados en esta investigación, el modelo antes señalado presenta evidencias que conducen a pensar que los estimadores del modelo antes referido son de varianza mínima.
Tabla 2. Comparación de modelos lineales para estimar el área foliar en pasto B. hibrido cv. Cayman en función del largo y ancho de la hoja
|
Modelo |
Coeficientes |
R2 |
AIC |
EER |
|||
|
β0 |
β1 |
β2 |
β3 |
||||
|
Lineal simple
|
-20,43 |
2,49 |
|
|
0,98 |
436,12 |
1,89 |
|
Cuadrático
|
-8,10 |
1,36 |
0,02 |
|
0,98 |
419,06 |
1,74 |
|
Cubico
|
51,28 |
-7,16 |
0,41 |
0,41 |
0,98 |
378,71 |
1,43 |
|
Lineal simple
|
13,54 |
16,82 |
|
|
0,14 |
836,30 |
12,74 |
|
Cuadrático
|
-56,92 |
104,73 |
-26,45 |
|
0,21 |
830,25 |
12,32 |
|
Cubico
|
15,63 |
-34,00 |
58,88 |
-16,93 |
0,21 |
831,46 |
12,33 |
|
Lineal múltiple
|
-21,76 |
2,47 |
1,166 |
|
0,98 |
434,62 |
1,87 |
|
Lineal múltiple con interacción
|
-19,88 |
2,39 |
-0,02 |
0,05 |
0,98 |
436,32 |
1,87 |
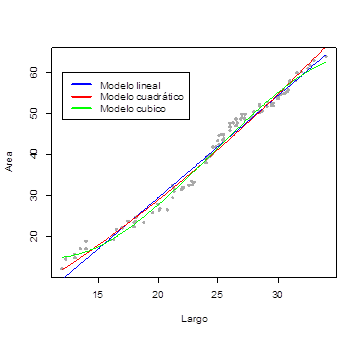
Figura 3. Ajuste de modelos lineales para estimar el área foliar en pasto B. hybrido cv. Cayman en función del largo de la hoja.
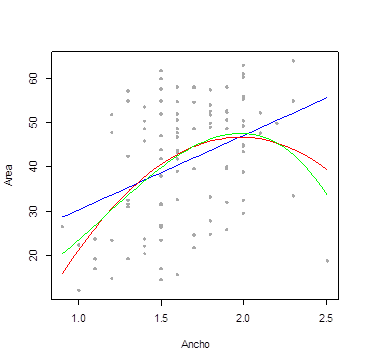
Figura 4. Ajuste de modelos lineales para estimar el área foliar en pasto B. hybrido cv. Cayman en función del ancho de la hoja.
Estos resultados difieren de los reportados por Bianco et al (2005), quienes en un ensayo para estimar el área foliar en una especie de Brachiaria, sugieren que el mejor modelo para tales fines es el lineal simple. De lo anterior se puede inferir que, el parámetro que determina el área foliar en pasto B. hybrido cv. Cayman es el largo de la hoja. Esto coincide con lo señalado en varios trabajos en pastos, como los realizados por Del Pozo et al., (1998), quienes también encontraron una alta relación entre el área foliar y el largo de la hoja en el pasto estrella (Cynodon nlemfuensis).
IV. CONCLUSIONES
El parámetro que determinó el área foliar en pasto B. hybrido cv. Cayman fue el largo de la hoja. Así mismo, el mejor modelo para estimar el área foliar en éste hibrido fue el modelo cubico expresado como función del largo de la hoja. Por su parte, la metodología empleada en esta investigación sugiere que, además del coeficiente de determinación del modelo (R2), los mejores criterios para seleccionar modelos para la estimación del área foliar en pasto B. hybrido cv. Cayman son el AIC y el EER. Finalmente, en virtud de los resultados obtenidos en esta investigación, se recomienda un estudio más exhaustivo que involucre otras variedades de pasto del género Brachiaria que permitan verificar la consistencia de los estimadores.
V. REFERENCIAS BIBLIOGRÁFICAS
Beerling, D. J. y J. C. Fray. 1990. “A comparison of the accurate variability and speed of five different methods for estimating leaf area.” Ann. Bot. 65: 483-488.
Bianco, S., R. Pitelli, y M. Bianco. 2005. “Estimación del área foliar de Brachiaria plantaginea usando dimensiones lineales de la hoja.” Planta Daninha 23(4): 597-601.
Bulynck, I., F. Fiorani, y H. Lambers. 1999. “Control of leaf growth and its role in determining in variation in plant growth rate from an ecological perpective.” Plant. Biol. (1): 13-18.
Cittadini, E. D. y P. L. Peri. 2006. “Estimation of leaf area in sweet cherry using a non-destructive method.” RIA 35 (1): 143-150.
Cornelissen, H., P. Castr-Diez, y R. Hunt. 1996. “Seedling growth, allocation and leaf attributes in a wide range of woody plant species and types.” J. Ecol. (84): 755-765.
Craig-Macfarlane, C., M. Hoffman, D. Eamus, N. Kerp, S. Higginson, R. Mcmurtrie, y M. Adams. 2007. “Estimation of leaf area index in eucalypt forest using digital photography.” Agric. Forest. Meteorol. 143: 176–188.
Del Pozo, P. 1998. Análisis del crecimiento del pasto estrella (C. nlemfuensis) bajo condiciones de corte y pastoreo. Tesis de Doctorado. Instituto Superior de Ciencias Agropecuarias de la Habana Fructuoso Rodríguez Pérez. La Habana (Cuba)
Demirsoy, H., L. Demirsoy., A. Öztürk. 2005. “Improved model for the non-destructive estimation of strawberry leaf area.” Fruits. 60: 69-73.
Eriksson, H., L. Eklundh, K. Hall, y A. Lindroth. 2005. “Estimating LAI in deciduous forest stands.” Agric. Forest Meteorol. 129: 27-37.
Galindo, J., y J. Clavijo, J. 2007. “Modelos alométricos para estimar el área de los foliolos de arveja (Pisum sativum L.).” Revista Científica Ciencia y Tecnología Agropecuaria. 8 (1): 37–43.
Jonckheere, I., S. Fleck, K. Nackaerts, B. Muys, P. Coppin, y F. Baret. 2004. “Review of methods for in situ leaf area index determination Part I. Theories, sensors and hemispherical photography.” Agric. Forest Meteorol. 121: 19–35.
Körner, C. 1991. “Some often overlooked plant characteristics as determinants of plant growth: a reconsideration.” Funct Ecol. (5): 162-173.
Kucharik, C. J., J. M. Norman, y S. T.Gower. 1998. “Measurements of branch area and adjusting leaf area index to indirect measurements.” Agric. Forest Meteorol. 91: 69-88.
Levy, P. y P. Jarvis. 1999. “Direct and indirect measurements of LAI in millet and fallow vegetation in HAPEX-Sahel.” Agric. Forest. Meteorol. 97: 199- 212.
Nautival, B. M, P. K. Singh, R. N. Sukla, S. Prakash, y A. Kumar. 1990. “Correcting leaf area measurement by conventional methods: a new approach for apple (Malus domestica Borkh).” J. Hort. Sc. 65(1): 15-18.
Peksen, E. 2007. “Non-destructive leaf area estimation model for faba bean (Vicia faba L.)”. Scientia Hort. 113: 322-328.
Poorter, H. y C. Remkes. 1990. “Leaf area ratio and net assimilation rate of 24 wild species differing in relative growth rate.” Oecol. (83): 553-559.
Roberts, S. T., T. L. Evans, J. W. McCombs, R. L. Harrington, y P. A. Glass. 2005. “Estimating individual tree leaf area in loblolly pine plantations using LiDAR derived measurements of height and crown dimensions.” Forest. Ec. Man. 213: 54-70.
Ross, J. 1981. The radiation regime and architecture of plant stands. La Haya (Holanda): Dr. W. Junk Publisher.
Sastre, P., G. Rey, C. Boubeé, y A. Piazza. 2002. “Estimación del área foliar en plantas de trigo.” En VII Reunión Nacional DOMEFA (Docentes de Matemática en Facultad de Agronomía, Forestales y Afines de la República Argentina). Catamarca (Argentina).
Solórzano P. 1988. “Determinación de área foliar en sorgo granero (Sorghum bicolor L. Moench) a diferentes edades.” Agronomía Tropical. 26 (1): 39-45.
Sonnentag, O., J. Talbot, J. Chen, y N. Roulet. 2008. “Using direct and indirect measurements of leaf area index to characterize the shrub canopy in an ombrotrophic peatland.” Agric. Forest. Meteorol. 144: 200-212.