Calidad de las carnes producidas en la región Amazonas, Perú
Quality of the meats produced in the Amazon region, Peru
Jhony A. Gonzales Malca1*![]() ,
Segundo M. Portocarrero Villegas1, María S. Abanto López1
,
Segundo M. Portocarrero Villegas1, María S. Abanto López1
1Universidad Nacional Toribio Rodríguez de Mendoza de Amazonas (UNTRM-A), Instituto de Investigación en Ganadería y Biotecnología, Laboratorio de Investigación en Sanidad Animal, Calle Higos Urco N° 342-350-356, Calle Universitaria N° 304, Chachapoyas, Perú
*Autor de correspondencia. E-mail: jhony.gonzales@untrm.edu.pe
Recibido, 04/11/2018 Aceptado, 02/04/2019 DOI:10.25127/aps.20191.481
![]()
RESUMEN
Palabras claves: Calidad, carnes, pollo, res, cerdo.
ABSTRACT
In the present investigation the quality of the meats produced in the Amazon region was evaluated, for which the physical, chemical and microbiological analysis of 190 samples, 12 samples and 26 species, distributed in 135 samples of chicken, 31 samples were made of beef and 24 samples of pork. The physical parameters were evaluated: hydrogen potential (pH), acidity (g of lactic acid / g of sample) and humidity; chemicals: protein, fat and energy; and microbiological: total coliforms, fecal coliforms, viable mesophilic aerobic bacteria, salmonella, and enterobacteria, to be later contrasted with the corresponding regulations. By means of obtaining values of the t-student statistic with probabilities higher than a level of significance (a) of 0.05, which is translated in does not mean, indicating the acceptance of the hypothesis of the hypothesis, which expresses values of the evaluated parameters that do not exceed the maximum allowable limits according to the regulations in force. Why the authorities should implement a new integrated and preventive approach in safety, where control actions are required and controlled throughout the food chain, guaranteeing the quality of the product to be marketed and consumed.
Key words: Quality, meat, chicken, beef, pork.
I. INTRODUCCIÓN
Hoy conocemos que la calidad de carnes frescas tiene que ver con los atributos que el consumidor busca y valora en el momento de comprar. Además, sabemos que la carne es un alimento importante para la salud del ser humano y parte significativa del presupuesto de la canasta familiar (Cáffaro-Tommasiello et al., 2018). El consumidor actual no solo está interesado en consumir alimentos ricos y en cantidad, sino que también se preocupa por su calidad y los beneficios que estos le pueden aportar a la salud, exigiendo productos de calidad basado en características que llenen sus necesidades tanto nutritivas como de inocuidad (Olivas et al., 2017).
Las carnes frescas y procesadas ofrecen numerosos beneficios nutricionales. Sin embargo, su consumo es sometido a un escrutinio cada vez más riguroso debido a los riesgos de salud asociados con citotoxinas que podrían generarse durante la preparación de éstos (Nahuatt et al, 2017). Los productos cárnicos de origen animal pueden contaminarse en cualquiera de las etapas de procesamiento (Friedrich et al., 2008); estas etapas comprenden desde la producción en la granja (que incluye aspectos tales como sanidad, bioseguridad, manejo, genética y alimentación) hasta el transporte, beneficio y ulterior procesamiento, conservación y distribución del producto terminado (Hambrecht et al., 2003; Jerez-Timaure et al., 2013).
A objeto de diagnosticar el estado actual de los cárnicos producidos en el Departamento Amazonas, se tomaron muestras a nivel de vendedor, comercializador y productor. Estas muestras fueron contrastadas con los parámetros referenciales establecidos en la NTS-071-MINSA/DIGESA-V.01, y este contraste se realizó aplicando el estadístico t-student, debido a que la varianza poblacional es desconocida y el tamaño de muestra es inferior a 30. Este procedimiento permitió precisar evidencias acerca del comportamiento de los valores obtenidos en las muestras con respecto a los parámetros que establece la norma. El análisis fue realizado sobre la base de la información recopilada para cárnicos en las distintas provincias que conforman el Departamento Amazonas, desde el productor hasta los responsables de colocar el rubro en manos del consumidor final.
Esta caracterización tiene por objetivo conocer la calidad sanitaria e inocuidad de los cárnicos que se producen y se comercializan en el Departamento Amazonas, y así tomar las medidas que el caso amerita para garantizar productos aptos para el consumo que no afecten la salud humana.
II. MATERIALES Y MÉTODOS
Área de Estudio
La ejecución de esta investigación se desarrolló en seis provincias del Departamento Amazonas: Chachapoyas, Utcubamba, Bagua, Rodríguez de Mendoza, Luya, y Bongará.
Figura 1. Mapa de ubicación del área de estudio en las provincias del Departamento Amazonas.
Tamaño de muestra
Los centros muestreados situados en las diferentes provincias del Departamento Amazonas han sido determinados según la base de datos del Servicio Nacional de Sanidad Agraria (SENASA), y las entidades competentes por cada sector. Se realizó un muestreo a nivel de procesador (camales y avícolas) donde se recogieron 190 muestras, procedentes de 12 camales y 26 avícolas. Al finalizar se obtuvieron 135 muestras de pollo, 31 muestras de carne de res y 24 muestras de carnes de cerdo recolectadas en las provincias de Chachapoyas, Bagua, Utcubamba, Luya, Rodríguez de Mendoza y Bongará.
Muestras y técnicas
El material biológico utilizado para realizar la evaluación fisicoquímica y microbiológica de 190 muestras de productos cárnicos (12 camales y 26 avícolas), fueron los músculos de la región de la pierna en las diferentes especies. Se recolectaron 300 g de carne fresca de animales pos faenado y 200 g de productos cárnicos secos en los centros de venta. Se colocaron de manera individual en bolsas ziploc identificadas con código único y trasladadas en cadena de frío al Laboratorio de Enfermedades Infecciosas y Parasitarias de Animales Domésticos de la UNTRM, donde se fraccionó, 50 g para análisis químico y 50 g para análisis físico en ambos tipos de muestras, mientras que para el análisis microbiológico se utilizaron 200 g de carne fresca y 100 g de producto cárnico seco.
En el análisis físico se determinaron dos parámetros, el potencial de Hidrógeno utilizando un pH-metro (marca OAKTON Ph 450), y la humedad colocando en la estufa (ECOCELL LSIS – B2V / EC a 60ºC) la muestra dentro de una placa Petri para luego aplicar el cálculo de porcentaje de humedad (M1 - M2) x 100/(M1 - M0). Se analizaron tres parámetros químicos, y se utilizó el Método Kjeldhal para la determinación de Proteína, el Método Soxhlet para determinación de grasa, y el método de combustión para la determinación de energía. En los análisis microbiológicos se determinaron coliformes totales y termotolerantes mediante la técnica del número más probable (NMP). Para detección de Salmonella sp, Shigella sp y enterobacterias se realizó mediante la técnica de siembra directa por estría en placa y para el conteo de bacterias aerobias mesófilas viables en placa se utilizó la técnica de siembra por incorporación. La determinación de histamina se realizó mediante ultra cromatografía líquida con el equipo UHPLC de marga Agilent Technologies modelo Infinity II 1290.
Análisis de datos
Debido a que la varianza poblacional es desconocida y el tamaño de muestra es inferior a 30 se realizó un análisis aplicando el estadístico t-student. Este permitió precisar evidencias acerca del comportamiento de los valores obtenidos en las muestras con respecto a los parámetros que establece la norma vigente.
III. RESULTADOS
Los resultados obtenidos en los análisis realizados y descritos anteriormente están reflejados en las Tablas 1, 2 y 3, las cuales se muestran a continuación.
Tabla 1. Resultados de la prueba de hipótesis de parámetros físicos, químicos y microbiológicos para carne de pollo a nivel de productor
|
PARÁMETROS |
PROVINCIAS |
|||||||
|
BAGUA |
BONGARÁ |
CHACHAPOYAS |
LUYA |
MENDOZA |
UTCUBAMBA |
|||
|
Físicos |
Acidez titulable |
t: 4,359* |
t: 4,169* |
t: 3,669* |
t: 3,746* |
t: 3,843* |
t: 4.779* |
|
|
P: 0,018 |
P: 0,017 |
P: 0,031 |
P: 0,034 |
P: 0,014 |
P: 0.027 |
|||
|
pH |
t: 3,915* |
t: 3,965* |
t: 4,349* |
t: 4,277* |
t: 3,468* |
t: 3.662* |
||
|
P: 0,022 |
P: 0,025 |
P: 0,028 |
P: 0,021 |
P: 0,039 |
P: 0.026 |
|||
|
Humedad |
t: 3,759* |
t: 3,639* |
t: 3,725* |
t: 3,519* |
t: 4,715* |
t: 4.409* |
||
|
P: 0,029 |
P: 0,031 |
P: 0,031 |
P: 0,029 |
P: 0,015 |
P: 0.025 |
|||
|
Químicos |
Proteína (%) |
t: 0,97ns |
t: 1,19ns |
t: 1,54ns |
t: 1,75ns |
t: 1,35ns |
t: 1.35ns |
|
|
P: 0,346 |
P: 0,366 |
P: 0,372 |
P: 0,553 |
P: 0,353 |
P: 0.353 |
|||
|
Grasa (%) |
t: 1,25ns |
t: 1,28ns |
t: 1,66ns |
t: 1,55ns |
t: 1,53ns |
t: 1.53ns |
||
|
P: 0,345 |
P: 0,308 |
P: 0,416 |
P: 0,339 |
P: 0,319 |
P: 0.339 |
|||
|
Energía (%) |
t: 1,57ns |
t: 1,44ns |
t: 1,71ns |
t: 1,47ns |
t: 1,64ns |
t: 1.43ns |
||
|
P: 0,476 |
P: 0,356 |
P: 0,415 |
P: 0,319 |
P: 0,333 |
P: 0.339 |
|||
|
Microbiológicos |
Coliformes totales (NMP/ml) |
t: 0,64ns |
t: 0,69ns |
t: 1,75ns |
t: 1,55ns |
t: 1,56ns |
t: 1.45ns |
|
|
P: 0,426 |
P: 0,516 |
P: 0,315 |
P: 0,335 |
P: 0,325 |
P: 0.235 |
|||
|
Coliformes fecales (NMP/ml) |
t: 1,01ns |
t: 1,11ns |
t: 1,51ns |
t: 1,48ns |
t: 1,51ns |
t: 1.71ns |
||
|
P:0,344 |
P:0,451 |
P: 0,433 |
P: 0,493 |
P: 0,553 |
P: 0.400 |
|||
|
Salmonella |
t: 0,97ns |
t: 0,84ns |
t: 1,44ns |
t: 1,74ns |
t: 1,90ns |
t: 1.40ns |
||
|
P: 0,381 |
P: 0,551 |
P: 0,314 |
P: 0,295 |
P: 0,514 |
P: 0.389 |
|||
|
Shigella |
t: 1,18ns |
t: 1,38ns |
t: 1,64ns |
t: 1,55ns |
t: 1,54ns |
t: 1.64ns |
||
|
P: 0,465 |
P: 0,265 |
P: 0,335 |
P: 0,331 |
P: 0,435 |
P: 0.331 |
|||
|
Enterobacterias |
t: 1,55ns |
t: 1,58ns |
t: 1,65ns |
t: 1,62ns |
t: 1,66ns |
t: 1.61ns |
||
|
P:0,327 |
P:0,367 |
P: 0,335 |
P: 0,307 |
P: 0,425 |
P: 0.385 |
|||
|
Bacterias aeróbicas mesófilas viables (UFC/ml) |
t: 1,45ns |
t: 1,59ns |
t: 1,34ns |
t: 1,38ns |
t: 1,37ns |
t: 1.64ns |
||
|
P:0,284 |
P:0,324 |
P: 0,519 |
P: 0,382 |
P: 0,402 |
P: 0.449 |
|||
|
Histamina (µg/ml) |
t: 1.69ns |
t: 1,75ns |
t: 1,49ns |
t: 1,35ns |
t: 1,49ns |
t: 1,45ns |
||
|
P:0.346 |
P:0,256 |
P: 0,437 |
P: 0,351 |
P: 0,351 |
P: 0,537 |
|||
(ns: No significativo; *: Significativo; **: Altamente significativo)
Tabla 2. Resultados de la prueba de hipótesis de parámetros físicos, químicos y microbiológicos para carne de cerdo a nivel de productor
|
PARÁMETROS |
PROVINCIAS |
|||||||
|
BAGUA |
BONGARÁ |
CHACHAPOYAS |
LUYA |
MENDOZA |
UTCUBAMBA |
|||
|
Físicos |
Acidez titulable |
t: 5,543** |
t: 6,043** |
t: 7,315** |
t: 6,619** |
t: 3,439* |
t: 6.309** |
|
|
P: 0,003 |
P: 0,007 |
P: 0,000 |
P: 0,007 |
P: 0,026 |
P: 0.001 |
|||
|
pH |
t: 5,328** |
t: 6,818** |
t: 7,991** |
t: 6,754** |
t: 3,474* |
t: 5.579** |
||
|
P: 0,005 |
P: 0,005 |
P: 0,000 |
P: 0,003 |
P: 0,027 |
P: 0.009 |
|||
|
Humedad |
t: 6,015** |
t: 7,715** |
t: 6,998** |
t: 7,648** |
t: 3,775* |
t: 6.489** |
||
|
P: 0,008 |
P: 0,000 |
P: 0,002 |
P: 0,000 |
P: 0,027 |
P: 0.002 |
|||
|
Químicos |
Proteína (%) |
t: 1,32ns |
t: 1,34ns |
t: 1,17ns |
t: 1,61ns |
t: 1,77ns |
t: 1.88ns |
|
|
P: 0,351 |
P: 0,401 |
P: 0,556 |
P: 0,556 |
P: 0,476 |
P: 0.486 |
|||
|
Grasa (%) |
t: 1,69ns |
t: 1,51ns |
t: 1,36ns |
t: 1,75ns |
t: 1,87ns |
t: 1.81ns |
||
|
P: 0,321 |
P: 0,391 |
P: 0,455 |
P: 0,463 |
P: 0,475 |
P: 0.335 |
|||
|
Energía (%) |
t: 1,74ns |
t: 1,84ns |
t: 1,86ns |
t: 1,54ns |
t: 1,67ns |
t: 1.57ns |
||
|
P: 0,256 |
P: 0,336 |
P: 0,331 |
P: 0,334 |
P: 0,271 |
P: 0.361 |
|||
|
Microbiológicos |
Coliformes totales (NMP/ml) |
t: 1,65ns |
t: 1,50ns |
t: 1,43ns |
t: 1,63ns |
t: 1,57ns |
t: 1.50ns |
|
|
P: 0,355 |
P: 0,425 |
P: 0,451 |
P: 0,311 |
P: 0,271 |
P: 0.351 |
|||
|
Coliformes fecales (NMP/ml) |
t: 1,67ns |
t: 1,77ns |
t: 1,47ns |
t: 1,61ns |
t: 1,47ns |
t: 1.51ns |
||
|
P: 0,251 |
P: 0,327 |
P: 0,318 |
P: 0,377 |
P: 0,278 |
P: 0.418 |
|||
|
Salmonella |
t: 1,70ns |
t: 1,78ns |
t: 1,59ns |
t: 1,77ns |
t: 1,77ns |
t: 1.57ns |
||
|
P: 0,344 |
P: 0,335 |
P: 0,341 |
P: 0,361 |
P: 0,271 |
P: 0.441 |
|||
|
Shigella |
t: 1,74ns |
t: 1,58ns |
t: 1,67ns |
t: 1,61ns |
t: 1,57ns |
t: 1.52ns |
||
|
P: 0,385 |
P: 0,235 |
P: 0,436 |
P: 0,308 |
P: 0,276 |
P: 0.336 |
|||
|
Enterobacterias |
t: 1,84ns |
t: 1,15ns |
t: 1,59ns |
t: 1,39ns |
t: 1,67ns |
t: 1.61ns |
||
|
P: 0,541 |
P: 0,441 |
P:0,345 |
P:0,435 |
P:0,275 |
P:0.297 |
|||
|
Bacterias aeróbicas mesófilas viables (UFC/ml) |
t: 1,62ns |
t: 1,65ns |
t: 1,85ns |
t: 1,51ns |
t: 1,47ns |
t: 1.62ns |
||
|
P: 0,216 |
P: 0,316 |
P:0,208 |
P:0,347 |
P:0,207 |
P:0.337 |
|||
|
Histamina (µg/ml) |
t: 1.52ns |
t: 1,72ns |
t: 1,38ns |
t: 1,60ns |
t: 1,60ns |
t: 1,54ns |
||
|
P: 0.264 |
P: 0,384 |
P:0,341 |
P:0,370 |
P:0,201 |
P:0,341 |
|||
(ns: No significativo; *: Significativo; **: Altamente significativo)
Tabla 3. Resultados de la prueba de hipótesis de parámetros físicos, químicos y microbiológicos para carne de res a nivel de productor
|
PARÁMETROS |
PROVINCIAS |
||||||||||||
|
BAGUA |
BONGARÁ |
CHACHAPOYAS |
LUYA |
MENDOZA |
UTCUBAMBA |
||||||||
|
Vacuno Fresco |
Vacuno Cecina |
Vacuno Fresco |
Vacuno Cecina |
Vacuno Fresco |
Vacuno Cecina |
Vacuno Fresco |
Vacuno Cecina |
Vacuno Fresco |
Vacuno Cecina |
Vacuno Fresco |
Vacuno Cecina |
||
|
Físicos |
Acidez titulable |
t: 4,155* |
t: 6,156** |
t: 3,915* |
t: 9,016** |
t: 3,696* |
t: 5,927** |
t: 4,443* |
t: 3,901* |
t: 3,666* |
t: 6,112** |
t: 4,518* |
t: 3.771* |
|
P: 0,031 |
P: 0,009 |
P: 0,045 |
P: 0,000 |
P:0,035 |
P: 0,008 |
P: 0,021 |
P: 0,033 |
P: 0,021 |
P: 0,001 |
P: 0,018 |
P: 0.022 |
||
|
pH |
t: 3,489* |
t: 7,047** |
t: 3,779* |
t: 8,879** |
t: 4,177* |
t: 6,616** |
t: 3,818* |
t: 3,924* |
t: 4,387* |
t: 6,754** |
t: 4,458* |
t: 3.695* |
|
|
P: 0,033 |
P: 0,000 |
P: 0,041 |
P: 0,000 |
P: 0,021 |
P: 0,003 |
P: 0,035 |
P: 0,034 |
P: 0,020 |
P: 0,002 |
P:0,025 |
P: 0.022 |
||
|
Humedad |
t: 3,756* |
t: 10,546** |
t: 3,996* |
t: 7,827** |
t: 3,579* |
t: 7,117** |
t: 3,874* |
t: 3,665* |
t: 3,701* |
t: 8,897** |
t: 4,348* |
t: 3.769* |
|
|
P:0,031 |
P: 0,000 |
P:0,039 |
P: 0,000 |
P: 0,029 |
P: 0,000 |
P: 0,033 |
P: 0,025 |
P: 0,032 |
P: 0,000 |
P: 0,024 |
P: 0.028 |
||
|
Químicos |
Proteína (%) |
t: 1,65ns |
t: 1,67ns |
t: 1,59ns |
t: 1,71ns |
t: 1,19ns |
t: 1,39ns |
t: 0,88ns |
t: 1,65ns |
t: 0,97ns |
t: 1,44ns |
t: 0,91ns |
t: 1.65ns |
|
P: 0,453 |
P: 0,316 |
P: 0,433 |
P: 0,444 |
P: 0,226 |
P: 0,401 |
P: 0,654 |
P: 0,551 |
P: 0,326 |
P: 0,561 |
P: 0,326 |
P: 0.491 |
||
|
Grasa (%) |
t: 1,54ns |
t: 1,81ns |
t: 1,49ns |
t: 1,52ns |
t: 1,35ns |
t: 1,58ns |
t: 1,55ns |
t: 1,66ns |
t: 1,29ns |
t: 1,66ns |
t: 1,31ns |
t: 1.53ns |
|
|
P: 0,301 |
P: 0,315 |
P: 0,337 |
P: 0,325 |
P: 0,458 |
P: 0,421 |
P: 0,458 |
P: 0,411 |
P: 0,458 |
P: 0,421 |
P: 0,456 |
P: 0.521 |
||
|
Energía (%) |
t: 1,54ns |
t: 1,68ns |
t: 1,64ns |
t: 1,37ns |
t: 1,34ns |
t: 1,54ns |
t: 1,64ns |
t: 1,44ns |
t: 1,58ns |
t: 1,574ns |
t: 1,44ns |
t: 1.71ns |
|
|
P: 0,269 |
P: 0,361 |
P: 0,299 |
P: 0,378 |
P: 0,356 |
P: 0,316 |
P: 0,356 |
P: 0,246 |
P: 0,446 |
P: 0,456 |
P: 0,443 |
P: 0.456 |
||
|
Microbiológicos |
Coliformes totales (NMP/ml) |
t: 1,47ns |
t: 1,56ns |
t: 1,71ns |
t: 1,58ns |
t: 0,87ns |
t: 1,53ns |
t: 0,87ns |
t: 1,62ns |
t: 0,69ns |
t: 1,53ns |
t: 0,77ns |
t: 1.69ns |
|
P: 0,315 |
P: 0,351 |
P: 0,355 |
P: 0,362 |
P: 0,516 |
P: 0,415 |
P: 0,664 |
P: 0,255 |
P: 0,667 |
P: 0,455 |
P: 0,664 |
P: 0.655 |
||
|
Coliformes fecales (NMP/ml) |
t: 1,58ns |
t: 1,33ns |
t: 1,65ns |
t: 1,82ns |
t: 1,41ns |
t: 1,57ns |
t: 0,79ns |
t: 1,66ns |
t: 1,29ns |
t: 1,57ns |
t: 0,87ns |
t: 1.61ns |
|
|
P: 0,353 |
P: 0,318 |
P: 0,348 |
P: 0,294 |
P:0,331 |
P: 0,371 |
P:0,650 |
P: 0,241 |
P:0,551 |
P: 0,551 |
P:0,714 |
P: 0.651 |
||
|
Salmonella |
t: 1,91ns |
t: 1,58ns |
t: 1,07ns |
t: 1,73ns |
t: 1,54ns |
t: 1,71ns |
t: 0,93ns |
t: 1,78ns |
t: 0,74ns |
t: 1,50ns |
t: 0,81ns |
t: 1.72ns |
|
|
P: 0,224 |
P: 0,341 |
P: 0,459 |
P: 0,228 |
P: 0,221 |
P: 0,544 |
P: 0,551 |
P: 0,304 |
P: 0,641 |
P: 0,444 |
P: 0,751 |
P: 0.644 |
||
|
Shigella |
t: 1,42ns |
t: 1,59ns |
t: 1,81ns |
t: 1,67ns |
t: 1,38ns |
t: 1,61ns |
t: 1,58ns |
t: 1,67ns |
t: 1,37ns |
t: 1,64ns |
t: 1,58ns |
t: 1.73ns |
|
|
P: 0,335 |
P: 0,336 |
P: 0,411 |
P: 0,238 |
P: 0,455 |
P: 0,415 |
P: 0,531 |
P: 0,485 |
P: 0,455 |
P: 0,485 |
P: 0,357 |
P: 0.585 |
||
|
Enterobacterias |
t: 1,57ns |
t: 1,60ns |
t: 1,37ns |
t: 1,39ns |
t: 1,47ns |
t: 1,88ns |
t: 1,45ns |
t: 1,51ns |
t: 1,64ns |
t: 1,81ns |
t: 1,35ns |
t: 1.81ns |
|
|
P: 0,335 |
P:0,265 |
P: 0,319 |
P: 0,415 |
P:0,457 |
P: 0,533 |
P:0,257 |
P: 0,441 |
P:0,547 |
P: 0,441 |
P:0,467 |
P: 0.541 |
||
|
Aeróbicas mesófilas (UFC/ml) |
t: 1,53ns |
t: 1,49ns |
t: 1,74ns |
t: 1,37ns |
t: 1,56ns |
t: 1,78ns |
t: 1,61ns |
t: 1,51ns |
t: 1,64ns |
t: 1,67ns |
t: 1,67ns |
t: 1.66ns |
|
|
P: 0,319 |
P:0,287 |
P: 0,319 |
P:0,328 |
P:0,274 |
P: 0,469 |
P:0,324 |
P: 0,336 |
P:0,474 |
P: 0,336 |
P:0,574 |
P: 0.616 |
||
|
Histamina (µg/ml) |
t: 1.54ns |
t: 1,63ns |
t: 1,56ns |
t: 1,43ns |
t: 1,67ns |
t: 1,65ns |
t: 1,75ns |
t: 1,42ns |
t: 1,81ns |
t: 1,51ns |
t: 1,38ns |
t: 1,59ns |
|
|
P: 0.254 |
P:0,201 |
P: 0,347 |
P:0,349 |
P:0,316 |
P: 0,349 |
P:0,456 |
P: 0,267 |
P:0,311 |
P: 0,314 |
P:0,579 |
P: 0,564 |
||
(ns: No significativo; *: Significativo; **: Altamente significativo)
Análisis descriptivo de los parámetros físicos acidez titulable, pH y humedad
Con el propósito de realizar un análisis descriptivo de los parámetros físicos, acidez titulable, pH y humedad, por considerarlos los más relevantes en la situación objeto de estudio, se procedió a construir los gráficos “Box and Whisker Plot”, los cuales permiten observar una variabilidad alta y unos valores que exceden los límites máximos permisible para los parámetros antes mencionados (Figuras 2, 3 y 4).
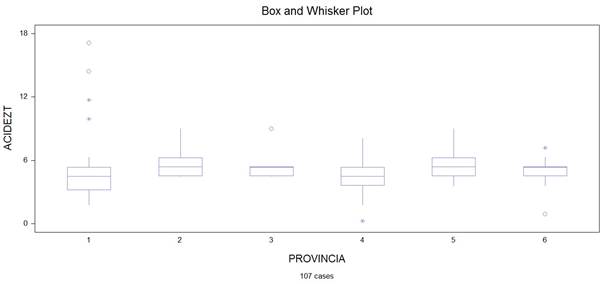
Figura 2. Provincias en función del parámetro acidez titulable.
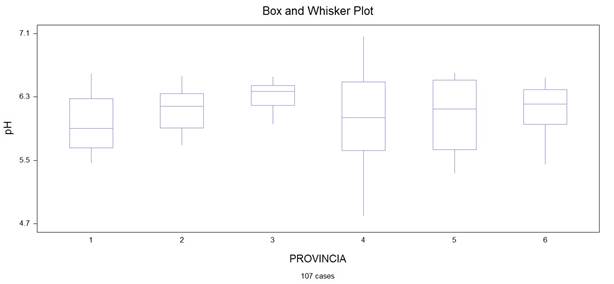
Figura 3. Provincias en función del parámetro pH.
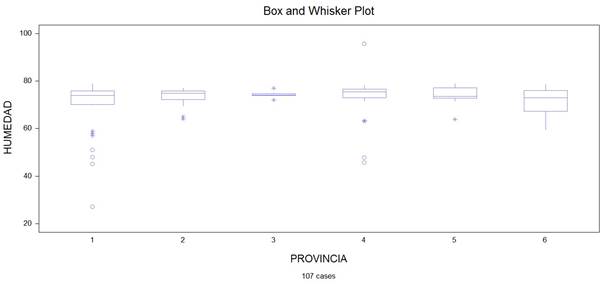
Figura 4. Provincias en función del parámetro humedad.
IV. DISCUSIÓN
En la presente investigación, al evaluar la calidad de las carnes producidas en el Departamento Amazonas, los resultados presentan evidencias que conducen a pensar que los parámetros químicos y microbiológicos tienen valores inferiores o iguales a los establecidos en la norma NTS N° 071-MINSA/DIGESA-V.01. Esto se demuestra por medio de la obtención de valores del estadístico t-student con probabilidades superiores a un nivel de significancia (α) de 0.05, que se traducen en no significativos, indicando la aceptación de la hipótesis nula, que expresa que valores de los parámetros evaluados no exceden los límites máximos permisibles según la norma antes citada, la cual establece los criterios microbiológicos de calidad sanitaria e inocuidad para los alimentos y bebidas de consumo humano. En cuanto a los parámetros físicos es conveniente señalar que estos si están fuera de los límites máximos permisibles establecidos por la norma. Los valores reportados en este estudio nos afirman que las parámetros físicos se encuentran por encima del límite máximo permitido indicando el alto grado de contaminación alcanzado en los productos cárnicos ofertados en el Departamento Amazonas, lo cual puede ser producto de las malas condiciones de higiene que tienen en todas las etapas de la cadena productiva, así como las condiciones de venta, provocando la mala calidad del producto y riesgos para la salud del consumidor. Un estudio similar demuestra que la mala calidad en productos cárnicos en el Perú sigue siendo un problema demostrándose en el informe del monitoreo de residuos químicos y otros contaminantes en alimentos agropecuarios primarios del año 2016, en los Departamentos de Piura, La Libertad, Lambayeque, Cajamarca, San Martín, Lima, Ica, Arequipa, Tacna y Puno (SENASA, 2018). Se analizaron un total de 1181 muestras de alimentos de origen animal y vegetal, de las cuales 910 muestras (77,05%) fueron conformes y 271 (22,95%) no conformes. Es decir, reportaron la presencia de agentes contaminantes microbiológicos que superaron los criterios establecidos en la Resolución Ministerial N° 591-2008/MINSA, “Norma sanitaria que establece los criterios microbiológicos de calidad sanitaria e inocuidad para los alimentos y bebidas de consumo humano”. De los 10 alimentos de origen animal, el 68,80% (289) de un total de 420 muestras fueron conformes a los análisis de contaminantes microbiológicos, mientras que el 31,20% (131 muestras) fueron muestras no conformes. La matriz que resultó con mayor número de muestras no conformes, se mostró así: carne de bovino con 31,9%, carne de porcino con 27,3%, carne de pollo con 25,8%. Estos resultados demuestran las malas condiciones en que se realiza toda la cadena producción, evidenciando que los consumidores llevan a su mesa productos de mala calidad, exponiendo la salud de sus familias. En este trabajo se demuestra que la calidad de las carnes se ven expuestas por parámetros físicos que superan los límites máximos permisibles, lo que repercute en producir carne menos tierna y de mal sabor, calidad y color (Grandin, 2000). De la misma manera se promueve el desarrollo de bacterias que contaminan la canal durante el sacrificio y el faenado. Estas bacterias deterioran la carne durante su almacenamiento, especialmente en ambientes cálidos, y es así como la carne desarrolla olores desagradables, cambios de color y rancidez (Lorenas-Muñoz, 2016). Esto debido a que el sacrificio desencadena múltiples cambios bioquímicos para la transformación del tejido muscular a carne, a medida que disminuye la concentración de oxígeno muscular se establece un metabolismo anaeróbico y acumulación de ácido láctico que provoca una reducción rápida de pH (Pérez y Ponce, 2013). Harris et al. (2012), mencionan que el músculo de un animal sano es esencialmente estéril, pero incluso en las condiciones más rigurosas, el músculo puede contaminarse con bacterias patógenas y de deterioro durante el proceso de recolección. Es por eso que el ácido láctico (LA) ha sido aprobado recientemente en la UE como descontaminante para la carne. Rodríguez-Melcón et al. (2017) encontraron que en las muestras tratadas con 4% de ácido láctico, el límite de vida útil del sensor se extendió más allá de 120 h, y esto sugiere que el tratamiento de la carne con 4% de LA no solo puede mejorar la calidad microbiológica, también puede mejorar las propiedades sensoriales y la vida útil.
V. CONCLUSIONES
Los productos cárnicos (pollo, cerdo, vacuno fresco y vacuno cecina) a nivel de productor evidencian parámetros físicos que superan los límites máximos permisibles, no ocurriendo así con los parámetros químicos y microbiológicos, los cuales se presentan dentro de los límites máximos establecidos por la norma. A la luz de los resultados encontrados a partir del procesamiento estadístico de la información es oportuno inferir la urgente necesidad de abordar esta problemática que pone en riesgo la salud pública y de no brindársele la atención que requiere, puede convertirse en un flagelo o vector que incida en la calidad de vida de la población, ya que a nivel de productor hay inconvenientes con los citados parámetros físicos.
VI. REFERENCIAS BIBLIOGRÁFICAS
Cáffaro-Tommasiello, E. M., M. E. Latorre, R. E. Cepeda, L. Garitta, M. Sosa, y P. P. Purslow. 2018. “Valoración de aspectos vinculados al consumo, calidad y seguridad de la carne, en consumidores argentinos de carne.” Idesia (Arica) 36 (3): 45-52.
Friedrich, L., I. Siró, I. Dalmadi, K. Horváth, R. Ágoston, y C. Balla. 2008. “Influence of various preservatives on the quality of minced beef under modified atmosphere at chilled storage.” Meat Science 79 (2): 332-343
Grandin, T. 2000. Beef cattle behavior, handling and facilities design. Colorado (USA): Grandin Livestock Systems Inc.
Hambrecht, E., J. J. Eissen, y M. W. A. Verstegen. 2003. “Effect of processing plant on pork quality.” Meat Science 64 (2): 125-131.
Harris, D., M. M. Brashears, A. J. Garmyn, J. C. Brooks, y M. F. Miller. 2012. “Microbiological and organoleptic characteristics of beef trim and ground beef treated with acetic acid, lactic acid, acidified sodium chlorite, or sterile water in a stimulated commercial processing environment to reduce Escherichia coli 0157:H7 and Salmonella.” Meat Science 90 (3): 783-788.
Jerez-Timaure, N., L. Arenas de Moreno, M. Sulbarán, y S. Uzcátegui. 2013. “Influencia del tiempo de reposo en las características de calidad de la canal y la carne de cerdos.” Revista Cubana de Ciencia Agrícola 47 (1): 55-60.
Lorenas-Muñoz, F. I. 2016. Evaluación de las variaciones de textura, color y pH en 3 cortes comerciales de carne bovina, envasados al vacío y almacenados en refrigeración a 4°C durante 90 días. Tesis de Maestría. Universidad de Concepción. Concepción (Chile).
Olivas, J. A., L. M. D. Tenorio, J. M. Xochihua, R. M. M. Barrios y J. F. H. Chavez. 2017. “Indicadores de calidad en carne de cerdo de diferentes centros comerciales de Ciudad Obregón, Sonora”. Nacameh 11 (2): 50-51.
Pérez M. L. y E. Ponce. 2013. Manual de prácticas de laboratorio: Tecnología de carnes. Ciudad de México (México): Universidad Autónoma Metropolitana.
Rodríguez-Melcón, C., C. Alonso-Calleja, y R. Capita. 2017. “Lactic acid concentrations that reduce microbial load yet minimally impact colour and sensory characteristics of beef.” Meat Science 129: 169-175.
SENASA (Servicio Nacional de Sanidad Agraria). 2018. Informe del monitoreo de residuos químicos y otros contaminantes en alimentos agropecuarios primarios, año 2016. Informe Técnico. Lima (Perú)